
 如图所示,利用2Ag+Cl2═2AgCl设计的原电池可测量空气中Cl2的含量(原电池的电解质是含有自由移动Ag+的固体物质).下列分析不正确的是( )
如图所示,利用2Ag+Cl2═2AgCl设计的原电池可测量空气中Cl2的含量(原电池的电解质是含有自由移动Ag+的固体物质).下列分析不正确的是( )| A. | 空气中c(Cl2)越大,Ag极消耗速率越快 | |
| B. | Ag+向Pt电极移动 | |
| C. | 电子由Ag电极经外电路流向Pt电极 | |
| D. | Ag电极上发生了还原反应 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验是化学研究的一种重要手段,现有如图所示A~G七种仪器,请根据要求填空.
实验是化学研究的一种重要手段,现有如图所示A~G七种仪器,请根据要求填空.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 和
和 E、CH3CH2CH2CH3和
E、CH3CH2CH2CH3和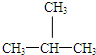
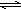 HCO3-+OH-
HCO3-+OH- 的系统命名为:3-甲基-4-乙基-庚烷
的系统命名为:3-甲基-4-乙基-庚烷 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com