
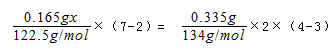


科目:高中化学 来源:不详 题型:单选题
| A.4 | B.5 | C.6 | D.7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 MnCl2+Cl2↑+2H2O,其中
MnCl2+Cl2↑+2H2O,其中 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 <_______。
<_______。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-=3SO42-+I-+3H+ |
| B.a点时消耗NaHSO3的物质的量为0.12mol |
| C.当溶液中I—与I2的物质的量之比为5:2时,加入的KIO3为0.18mol |
| D.b点时的还原产物可能是KI或NaI,b~c间的还原产物是I2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.R3O4,RO,2 :1 | B.RO2,RO, 1:3 |
| C.RO2,R3O4 ,1 : 2 | D.RO2,RO,1 : 4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
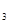 +H
+H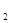 O
O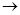 Al(OH)
Al(OH)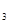 +N
+N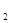 ↑+NaAlO
↑+NaAlO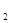 ,有关叙述正确的是( )
,有关叙述正确的是( )| A.上述反应中水是氧化剂 |
B.若反应过程中转移5 mol e 则生成标准状况下N 则生成标准状况下N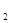 的体积为11.2L 的体积为11.2L |
C.该反应的氧化产物是N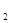 |
D.当消耗1 mol Al时,生成标况下N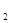 的体积为22.4L 的体积为22.4L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com