
| A、c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| B、c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C、c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| D、c(NH4+)>c(Cl-)>c(OH-)>c(H+) |


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
| A、MgCl2溶液 |
| B、Na2SiO3溶液 |
| C、Cu(NO3)2溶液 |
| D、Na[Al(OH)4]溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
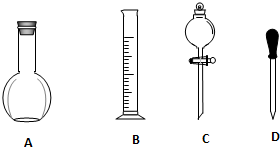
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 温度/℃ | 加入某盐 | H2SO4体积/mL | H2O体积/mL | 铝粉加入量/g | 铝粉溶解量/g |
| ① | 20 | 不加 | 40 | 0 | 2.0050 | 0.0307 |
| ② | 80 | 不加 | 40 | 0 | 2.0050 | 0.1184] |
| ③ | t1 | 不加 | 20 | V1 | 2.0050 | ﹨ |
| ④ | t2 | 5mL0.01mol?L-1 CuSO4溶液 | 20 | V2 | 2.0050 | ﹨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
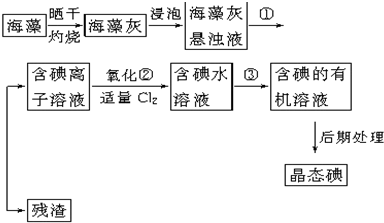 (1)指出提取碘的过程中有关的实验操作名称:①
(1)指出提取碘的过程中有关的实验操作名称:①查看答案和解析>>
科目:高中化学 来源: 题型:
| A、未加入稀盐酸之前c( CN-)>c(HCN) | ||
B、加稀盐酸后溶液中
| ||
| C、pH=7时,溶液中c( Na+)=c( CN-) | ||
| D、加稀盐酸后HCN的电离程度减小,但c( H+)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
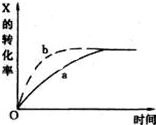 如图曲线a表示放热反应:X(g)+Y(g)?Z(g)+M(g)+N(s) 进行过程中x的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
如图曲线a表示放热反应:X(g)+Y(g)?Z(g)+M(g)+N(s) 进行过程中x的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )| A、升高温度 | B、加大X的投入 |
| C、加催化剂 | D、增大体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com