
| A. | 5.1 g | B. | 10.2 g | C. | 13.6 g | D. | 15.3 g |
分析 发生反应Mg+2HCl=MgCl2+H2↑,2Al+6HCl=2AlCl3+3H2↑,5.6L气体是氢气,氢气的物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,故参加反应的HCl的物质的量为0.25mol×2=0.5mol,溶液中n(HCl)=0.3L×2mol/L=0.6mol,大于参加反应的HCl的物质的量,故金属完全反应,反应后溶液中加入足量氨水,则镁离子、铝离子恰好完全转化为Mg(OH)2、Al(OH)3,则m(沉淀)=m(金属)+m(OH-),由生成的氢气的物质的量,根据电子注意守恒计算n(OH-),再根据m=nM计算m(OH-),最后计算出沉淀的质量.
解答 解:发生反应Mg+2HCl=MgCl2+H2↑,2Al+6HCl=2AlCl3+3H2↑,5.6L气体是氢气,氢气的物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,故参加反应的HCl的物质的量为0.25mol×2=0.5mol,溶液中n(HCl)=0.3L×2mol/L=0.6mol>0.5mol,则金属完全反应,
反应后溶液中加入足量氨水,镁离子、铝离子恰好完全转化为Mg(OH)2、Al(OH)3,
则m(沉淀)=m(金属)+m(OH-),
根据电子守恒可知:n(OH-)=2n(H2)=0.25mol×2=0.5mol,
所以生成沉淀的质量为5.1g+0.5mol×17g/mol=13.6g,
故选C.
点评 本题考查氧化还原反应的计算,为高考常见题型,侧重于学生的分析能力和计算能力的考查,注意电子守恒确定氢氧根离子的物质的量,题目难度中等.


科目:高中化学 来源: 题型:解答题

 ②实际生产过程中对所加稀硝酸的浓度控制要求比较高,通常用标准氢氧化钠溶液来滴定.滴定过程中若用酚酞作指示剂,终点现象是溶液由无色变成红色(或浅红色),且半分钟内不褪色.请在图中画出滴定过程中溶液的pH随所滴加氢氧化钠溶液体积的变化的曲线图(要求过A点).
②实际生产过程中对所加稀硝酸的浓度控制要求比较高,通常用标准氢氧化钠溶液来滴定.滴定过程中若用酚酞作指示剂,终点现象是溶液由无色变成红色(或浅红色),且半分钟内不褪色.请在图中画出滴定过程中溶液的pH随所滴加氢氧化钠溶液体积的变化的曲线图(要求过A点). .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | 只有①④⑤ | C. | 只有②③ | D. | 只有③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用A表示的反应速率是0.8mol/(L•min) | |
| B. | 2min末时的反应速率,用B表示为0.6mol/(L•min) | |
| C. | 用C表示的反应速率是0.4mol/(L•min) | |
| D. | 若用D表示反应速率是0.8mol/(L•min),则x=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
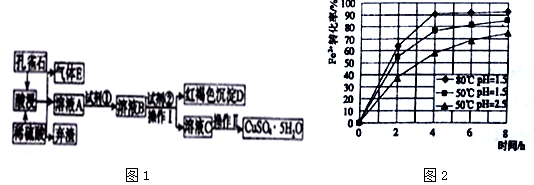
| 物质 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe(OH)3 | 2.2 | 3.2 |
| Fe(OH)2 | 7.6 | 9.6 |
| Cu(OH)2 | 4.7 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
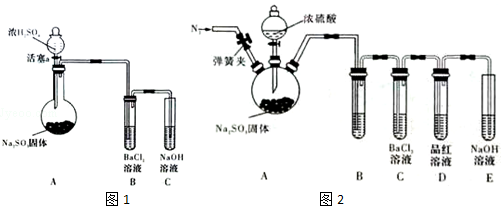
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
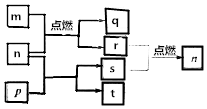 短周期主族元素X、Y、Z、W原子序数依次增大,m是W的单质,r是X的单质,s是Y的单质,n、p及q是这些元素组成的二元化合物;t由其中的三种元素组成,其水溶液呈碱性;p是淡黄色固体,q是一种耐高温材料,它们的关系如图所示.下列说法正确的是( )
短周期主族元素X、Y、Z、W原子序数依次增大,m是W的单质,r是X的单质,s是Y的单质,n、p及q是这些元素组成的二元化合物;t由其中的三种元素组成,其水溶液呈碱性;p是淡黄色固体,q是一种耐高温材料,它们的关系如图所示.下列说法正确的是( )| A. | Y、Z、W的简单离子的电子层结构相同 | |
| B. | 原子半径:r(X)<r(Y)<r(Z)<r(W) | |
| C. | 简单氢化物的稳定性:X>Y | |
| D. | Y与Z两种元素形成的化合物一定只含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
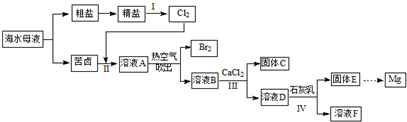
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
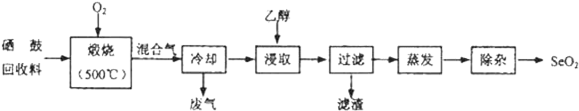
| 物质 | 熔点 | 沸点 | 溶解度 |
| SeO2 | 340℃(315℃升华) | 684℃ | 易溶于水和乙醇 |
| TeO2 | 733℃(450℃升华) | 1260℃ | 微溶于水,不溶于乙醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com