
在可逆反应中,平衡常数与反应进行的限度的关系正确的是( )
A.K越大,反应程度越大
B.K越大,反应程度越小
C.K的大小与反应程度无关
D.升高温度,K增大
 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
下列变化按氮元素只被氧化、只被还原、既不被氧化又不被还原、既可能被氧化又可能被还原的顺序排列正确的是( )
①高能固氮 ②硝酸分解 ③实验室制取氨气 ④氨氮废水脱氮(指将NH3或NH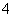 转化为N2)
转化为N2)
A.④②③① B.②①③④
C.③④②① D.③①④②
查看答案和解析>>
科目:高中化学 来源: 题型:
反应CH3OH (l)+NH3(g)====CH3NH2(g)+H2O(g)在某 温度自发向右进行,若反应|ΔH|=17 kJ·mol-1,|ΔH-TΔS|=17 kJ· mol-1,则下列正确的是( )
温度自发向右进行,若反应|ΔH|=17 kJ·mol-1,|ΔH-TΔS|=17 kJ· mol-1,则下列正确的是( )
A.ΔH >0,ΔH-TΔS<0
B.ΔH <0,ΔH-TΔS>0
C.ΔH >0,ΔH-TΔS>0
D.ΔH <0,ΔH-TΔS<0
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,改变反应物的用量或浓度,不会改变反应产物种类的是( )
A.炭粉在氧气中燃烧
B.CO2通入氢氧化钠溶液
C.铁在氯气中燃烧
D.铜和硝酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。计算该样品中氯的物质的量,并求出FeClx中x值:________(列出计算过程)。
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3的物质的量分数为________。在实验室中,FeCl2可用铁粉和________反应制备,FeCl3可用铁粉和________反应制备。
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为________________________。
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为________________________。与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为___________________,
该电池总反应的离子方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)
 NH3(g)+HI(g);
NH3(g)+HI(g);
②2HI(g)
 H2(g)+I2(g)
H2(g)+I2(g)
达到平衡时,[H2]=0.5 mol·L-1,[HI]=4 mol·L-1,则此温度下反应①的平衡常数为( )
A.9 mol2·L-2 B.16 mol2·L-2 C.20 mol2·L-2 D.25 mol2·L-2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.Al2O3难溶于水,不跟水反应,所以它不是Al(OH)3对应的氧化物
B.因为Al2O3是金属氧化物,所以它是碱性氧化物
C.Al2O3属于两性氧化物
D.Al2O3能与所有的酸、碱溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
与CH2===CH2―→CH2BrCH2Br属于同一反应类型的是( )
A.CH3CHO―→C2H5OH
B.C2H5OH―→CH2===CH2

D.CH3COOH―→CH3COOC2H5
查看答案和解析>>
科目:高中化学 来源: 题型:
生产铅蓄电池时,在两极板上的铅、锑合金棚架上均匀涂上膏状的PbSO4,干燥后再安装,充电后即可使用,发生的反应是
2PbSO4+2H2O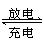
 PbO2+Pb+2H2SO4
PbO2+Pb+2H2SO4
下列对铅蓄电池的说法错误的是( )
A.需要定期补充硫酸
B.工作时铅是负极,PbO2是正极
C.工作时负极上发生的反应是Pb+SO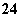 —→PbSO4+2e-
—→PbSO4+2e-
D.工作时电解质的密度减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com