
【题目】溶液的酸碱性可用酸度(AG)表示AG=lg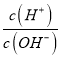 。室温下,某化学兴趣小组的同学用 0.01 mol·L-1的氢氧化钠溶液滴定20.00 mL 0.01 mol·L-1醋酸,滴定结果如下图所示,下列有关叙述中正确的是
。室温下,某化学兴趣小组的同学用 0.01 mol·L-1的氢氧化钠溶液滴定20.00 mL 0.01 mol·L-1醋酸,滴定结果如下图所示,下列有关叙述中正确的是
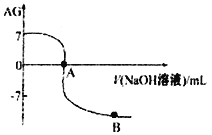
A. 水的电离程度A点小于B点
B. A点时加入的氢氧化钠溶液的体积恰好为20.00 mL
C. 室温0.01 mol·L-1醋酸溶液的电离平衡常数Ka=l0-5
D. 若B点时所加NaOH溶液的体积为40.00 mL,此时溶液中c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
【答案】C
【解析】A、A点常温时,中性溶液的pH=7,溶液中氢离子浓度等于氢氧根离子浓度,AG=lg1=0,B加碱,抑制水电离,水的电离程度A点大于B点,故A错误;B、A点呈中性,A点时加入的氢氧化钠溶液的体积大于20.00 mL;C、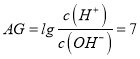 ,得c2(H+ )=10(―14+7)=10-7, 由CH3COOH
,得c2(H+ )=10(―14+7)=10-7, 由CH3COOH![]() CH3COO―+H+ 得Ka=c2(H+ )/C(CH3COOH)=10-7/0.01=l0-5,故C正确;D、若B点时所加NaOH溶液的体积为40.00 mL,溶液相当于等浓度的CH3COONa和NaOH的混合液,CH3COO― 部分水解,浓度比OH― 小,此时溶液中 c(Na+)>c(OH-)>c(CH3COO-)>c(H+),故D错误;故选C。
CH3COO―+H+ 得Ka=c2(H+ )/C(CH3COOH)=10-7/0.01=l0-5,故C正确;D、若B点时所加NaOH溶液的体积为40.00 mL,溶液相当于等浓度的CH3COONa和NaOH的混合液,CH3COO― 部分水解,浓度比OH― 小,此时溶液中 c(Na+)>c(OH-)>c(CH3COO-)>c(H+),故D错误;故选C。


科目:高中化学 来源: 题型:
【题目】下列关于溶液的说法正确的是
A. 溶液都是均一、稳定的纯净物
B. 饱和溶液的浓度一定大于不饱和溶液的浓度
C. 钠与氧气反应只能生成氧化钠
D. 实验室制取氯气的原料可选用浓盐酸和二氧化锰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铁锂(LiFePO4)电池是一种高效、环保的新型电池,装置如图所示,其中正极材料橄榄石型LiFePO4通过粘合剂附着在铝箔表面,负极石墨材料附着在铜箔表面,电解质为溶解在有机溶剂中的锂盐,电池工作时的总反应为:LiFePO4+6C ![]() Li1-xFePO4+LixC6,则下列说法错误的是
Li1-xFePO4+LixC6,则下列说法错误的是
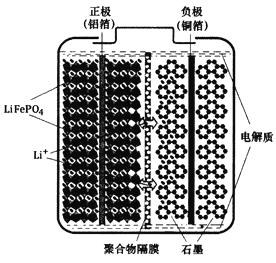
A. 装置中的聚合物隔膜应为阳离子交换膜
B. 充电时,Li+迁移方向为由右向左
C. 充电时,LiFePO4中的铁元素被氧化
D. 放电时,正极的电极反应式为:Li1-xFePO4+xLi++xe-=LiFePO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同分异构体具有:① 相同的相对分子质量 ② 相同的分子式 ③ 相同的最简式
④ 相同的物理性质 ⑤ 相同的化学性质
A.①②③B.①②④C.①②⑤D.②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017世界环境日中国主题:“绿水青山就是金山银山。”倡导保护自然,践行绿色生活,共同建设美丽中国。下列做法应提倡的是
A. 积极开发太阳能等新能源汽车 B. 推广使用一次性塑料袋和纸巾
C. 工业污水直接用于农田的灌溉 D. 大量生产防霾口罩以治理PM2.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质),某小组以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4。

己知:CeO2不溶于强酸或强碱;Ce3+易水解,酸性条件下,Ce4+有氧化性。
(1)滤液A的主要成分_____(填写化学式),滤液B所含金属阳离子为________。
(2)反应①的离子方程式是_________。
(3)反应①之前要洗涤滤渣B,对滤渣B进行“洗涤”的实验操作方法是________。
(4)反应②的化学反应方程式是____________。
(5)稀土元素的提纯,还可采用萃取法。己知化合物HT作为萃取剂能将铈离子从水溶液萃取出来,过程表示为Ce2(SO4)3(水层)+ 6HT(有机层)![]() 2CeT3(有机层)+3H2SO4(水层),用________ (填主要仪器)分液的到CeT3(有机层),再加入H2SO4获得较纯净的含Ce3+的水溶液。可选择硫酸作反萃取的原因是________。
2CeT3(有机层)+3H2SO4(水层),用________ (填主要仪器)分液的到CeT3(有机层),再加入H2SO4获得较纯净的含Ce3+的水溶液。可选择硫酸作反萃取的原因是________。
(6)用滴定法测定制得的Ce2(SO4)3产品纯度。
![]()
若所用FeSO4溶液在空气中露置一段时间后再进行滴定,则测得Ce(OH)4产品的质量分数______。(填“偏大”、“偏小”或“无影响”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com