

| A. | 实验I:逐滴滴加盐酸时,试管中立即产生大量气泡 | |
| B. | 实验Ⅱ:可比较氯、碳、硅三种元素的非金属性强弱 | |
| C. | 实验Ⅲ:从饱和食盐水中提取NaCl晶体 | |
| D. | 装置Ⅳ:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去 |
分析 A.先发生碳酸钠与盐酸的反应生成碳酸氢钠;
B.强酸制取弱酸,最高价含氧酸的酸性越强,非金属性越强,氯化氢为非含氧酸;
C.从饱和食盐水中提取NaCl晶体,利用蒸发操作;
D.浓硫酸具有脱水性,蔗糖变为C,然后与浓硫酸反应生成二氧化硫,具有还原性,使酸性KMnO4溶液褪色.
解答 解:A.先发生碳酸钠与盐酸的反应生成碳酸氢钠,则开始没有气泡,故A错误;
B.强酸制取弱酸可知酸性为盐酸>碳酸>硅酸,最高价含氧酸的酸性越强,非金属性越强,盐酸是非含氧酸,无法比较,故B错误;
C.从饱和食盐水中提取NaCl晶体,利用蒸发操作,不需要坩埚,应选蒸发皿,故C错误;
D.浓硫酸具有脱水性,蔗糖变为C,然后与浓硫酸反应生成二氧化硫,具有还原性,使酸性KMnO4溶液褪色,观察到性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去,故D正确;
故选D.
点评 本题考查实验方案的评价,涉及到反应的先后顺序、酸性强弱比较、蒸发等知识点,考查点较多,学生应注意思维的及时转换来解答,D选项难度较大.


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:解答题
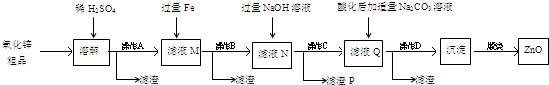
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是某校化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图.在烧瓶A中放一些新制的无水CuSO4粉末,并加入约20mL无水乙醇;锥形瓶B中盛放浓盐酸;分液漏斗C和广口瓶D中均盛浓H2SO4;干燥管F中填满碱石灰;烧杯作水浴器.当打开分液漏斗C的活塞后,浓H2SO4缓缓流入B中,D中导管口有气泡产生.过几分钟后,无水CuSO4变蓝,此时水浴加热,点燃F管口的气体,观察到绿色的火焰.试回答:
如图是某校化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图.在烧瓶A中放一些新制的无水CuSO4粉末,并加入约20mL无水乙醇;锥形瓶B中盛放浓盐酸;分液漏斗C和广口瓶D中均盛浓H2SO4;干燥管F中填满碱石灰;烧杯作水浴器.当打开分液漏斗C的活塞后,浓H2SO4缓缓流入B中,D中导管口有气泡产生.过几分钟后,无水CuSO4变蓝,此时水浴加热,点燃F管口的气体,观察到绿色的火焰.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下22.4LNO2中分子数约为NA个 | |
| B. | 常温下,18g${\;}_{\;}^{18}$O2中含有个NA氧原子 | |
| C. | 31g白磷中含的共价键数为3NA | |
| D. | 25℃时pH=13的NaOH溶液中含有0.1NAOH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何酸与碱发生中和反应生成1molH2O的过程中,能量变化均相同 | |
| B. | 同温同压下,H2(g)+Cl(g)=2HCl(g)在光照和点燃条件下的△H相同 | |
| C. | 已知:①H2(g)+O2(g)=2H2O(g)△H1=-akJ•mol-1,②2H2(g)+O2(g)=2H2O(I)△H2=-bkJ•mol-1,则a>b | |
| D. | 已知:①C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1,②C(s,金刚石)+O2(g)=CO2(g)△H2=-393.0kJ•mol-1,则金刚石比石墨稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com