
| A. | 标准状况下,0.1 mol/L CH3COONa溶液中,CH3COO-个数小于0.1NA | |
| B. | K、Zn分别与稀硫酸反应所得溶液均呈中性 | |
| C. | Fe分别与氯气和稀盐酸反应所得氯化物相同 | |
| D. | C、P、S、Cl的最高价氧化物对应水化物的酸性逐渐增强 |
分析 A.根据n=cV计算物质的量和个数;
B.硫酸锌在溶液中水解显酸性;
C.Fe与强氧化性物质反应可能生成高价态产物;
D.元素的非金属性越强,其最高价氧化物对应水化物的酸性越强.
解答 解:A.根据n=cV可以计算物质的量,0.1 mol/L CH3COONa溶液中,由于没有给出体积,所以不能计算物质的量,也不能计算离子数目,故A错误;
B.K、Zn分别与稀硫酸反应生成硫酸钾和硫酸锌,硫酸锌在溶液中水解显酸性,故B错误;
C.Fe与HCl反应生成氯化亚铁,Fe与氯气反应生成三氯化铁,故C错误;
D.元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,非金属性:C、P、S、Cl依次增强,则C、P、S、Cl的最高价氧化物对应水化物的酸性逐渐增强,故D正确.
故选D.
点评 本题考查了物质的量的计算、盐的水解、Fe元素的化学性质、元素周期律等,题目难度不大,侧重于考查学生对基础知识的应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
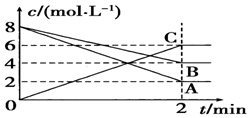 某温度时,在2L密闭容器中,某一化学反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得:
某温度时,在2L密闭容器中,某一化学反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳氢化合物就是我们所说的烃 | |
| B. | 这一发现可以为我们提供足够的化石燃料,从而减少开发新能源的投资 | |
| C. | 从石油中可以获得重要的有机化工原料--乙烯 | |
| D. | 相同质量的碳氢化合物中氢的质量分数越高,完全燃烧时消耗的O2越多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若a是铁,b是稀硝酸(过量)且a可溶于c溶液中.则a与b反应的离子方程式为Fe+4H++NO3-=Fe3++NO↑+2H2O | |
| B. | 若c,d为气体,且都能使澄清石灰水变浑浊,则将此混合气体通入溴水中,橙色褪去,其褪色过程的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br- | |
| C. | 若c是无色刺激性气味的气体,其水溶液显弱碱性,在标准状况下用排空气法收集c气体得平均摩尔质量为20 g•mol-1的混合气体进行喷泉实验.假设溶质不扩散,实验完成后所得溶液的物质的量浓度约为0.056 mol•L-1 | |
| D. | 若a是造成温室效应的主要气体之一,c、d均为钠盐,参加反应的a、b物质的量之比为4:5,则上述反应的离子方程式为4CO2+5OH-=CO32-+3HCO3-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
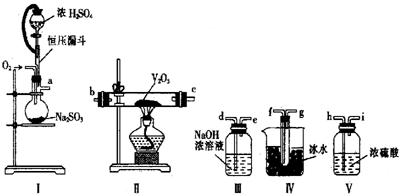
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
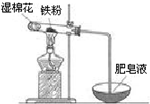 铁是日常生活中用途最广、用量最大的金属材料.
铁是日常生活中用途最广、用量最大的金属材料.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com