
| A. |  | B. |  | C. |  | D. | HO-CH2-CH2OH |
分析 甲经氧化后得乙(分子式为C2H3O2Cl),乙应为CH2ClCOOH,说明甲中含有能被氧化的官能团,可能为-OH或-CHO,甲经水解可得丙,1mol丙和2mol乙反应的一种含氯的酯(C6H8O4Cl2),说明丙中含有两个-OH,应为CH2OHCH2OH,则甲为CH2ClCH2OH.
解答 解:乙应为CH2ClCOOH,甲经水解可得丙,1mol丙和2mol乙反应的一种含氯的酯(C6H8O4Cl2),说明甲水解后生成
CH2OHCH2OH,则甲为CH2ClCH2OH.
故选A.
点评 本题考查有机物的推断,题目难度中等,本题注意根据乙的分子式确定乙的结构简式,根据丙和乙反应产物确定甲的组成和结构.


科目:高中化学 来源: 题型:选择题
| A. | 电解结束后,在阳极底部会有阳极泥产生,主要成分是铁、金和银 | |
| B. | 电解结束后,溶液中Cu2+浓度变大 | |
| C. | 纯铜作阳极,粗铜作阴极,硫酸铜为电解质溶液 | |
| D. | 粗铜作阳极,纯铜作阴极,硫酸铜为电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Th元素的质量数是232 | B. | 230Th和232Th的化学性质相同 | ||
| C. | 232Th转化成233U是化学变化 | D. | Th元素的相对原子质量是231 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③④ | C. | ①②④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.08mol/L | B. | 0.08mol/(L•s) | C. | 0.04mol/(L•min) | D. | 0.04 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
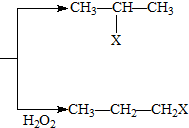 (X为卤素原子)
(X为卤素原子)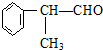 的物质,该物质是一种香料.
的物质,该物质是一种香料.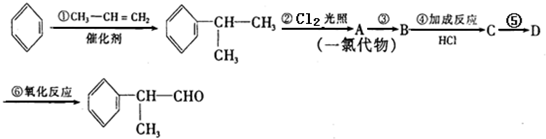
 .
.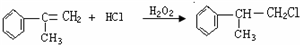 .
.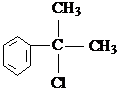 的水解产物
的水解产物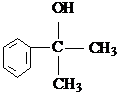 不能经氧化反应⑥而得到产品.
不能经氧化反应⑥而得到产品.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$ +2NaBr.
+2NaBr.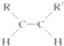 $\stackrel{O_{2}}{→}$ $\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO.请写出下列反应产物的结构简式:
$\stackrel{O_{2}}{→}$ $\stackrel{H_{2}O/Zn}{→}$RCHO+R′CHO.请写出下列反应产物的结构简式: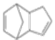 $\stackrel{O_{2}}{→}$ $\stackrel{H_{2}O/Zn}{→}$
$\stackrel{O_{2}}{→}$ $\stackrel{H_{2}O/Zn}{→}$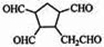 .
. ).若考虑苯环上的烯基侧链经酸性高锰酸钾溶液氧化得羧基,写出A所有可能的结构简式(不考虑立体异构):
).若考虑苯环上的烯基侧链经酸性高锰酸钾溶液氧化得羧基,写出A所有可能的结构简式(不考虑立体异构):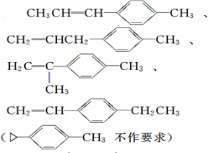 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
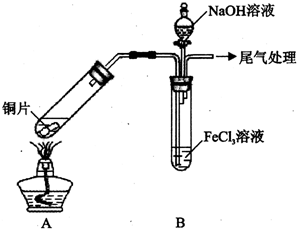 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示(夹持仪器已略去).
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示(夹持仪器已略去).| 步骤② | 往5mL 1mol•LFeCl3溶液中通入SO2气体,溶液立即变为红棕色.微热在较短时间内溶液颜色变为浅绿色. |
| 步骤③ | 往5mL重新配制的1mol•L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色.短时间内发现溶液颜色变成浅绿色. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com