
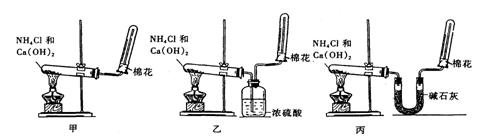
 为了在实验室制取干燥的氨气,甲、乙、丙三位同学分别设计了如下三套实验装置
为了在实验室制取干燥的氨气,甲、乙、丙三位同学分别设计了如下三套实验装置
(1)实验装置和所用药品都正确的是(填“甲”、“乙”或“丙”) 。
(2)写出制取氨气的化学方程式 。
(3)如何检验氨气是否收集满(简述操作方法、现象和结论)
科目:高中化学 来源: 题型:
下表中的陈述均正确并且前后存在因果关系的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | SO2有漂白性 | SO2可使溴水和酸性高锰酸钾溶液褪色 |
| B | Fe3+有强氧化性 | FeCl3溶液可用于回收废旧电路板中的铜 |
| C | 浓硫酸有吸水性 | 浓硫酸可使蔗糖和纸张碳化变黑 |
| D | SiO2有导电性 | SiO2可用于制备光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:
向含有等物质的量的NH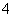 、Al3+、H+的混合溶液中,慢慢滴加NaOH溶液直至过量,并不断搅拌,依次发生了数个离子反应,则第三个离子反应是( )
、Al3+、H+的混合溶液中,慢慢滴加NaOH溶液直至过量,并不断搅拌,依次发生了数个离子反应,则第三个离子反应是( )
A.H++OH-===H2O
B.Al3++3OH-===Al(OH)3↓
C.Al(OH)3+OH-===AlO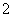 +2H2O
+2H2O
D.NH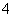 +OH-===NH3·H2O
+OH-===NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
气体甲能使湿润的红色石蕊试纸变蓝,气体乙可在空气中产生白雾,当甲与乙相遇时可能生成
A.NH4C1 B.NH4HCO3 C.(NH4)2CO3 D.(NH4)2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
0.1 mol某金属单质与足量的盐酸反应,放出1.12LH2(标准状况),并转变为具有Ar原子的电子层结构的离子,该金属元素在元素周期表中的位置是
A.第三周期第IA族 B.第四周期第IA族
C.第三周期第ⅡA族 D.第四周期第ⅡA族
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.同一原子中,2p、3p、4p能级的轨道数依次增多
B.电子排布式(22Ti)1s22s22p63s23p10违反了能量最低原则
C.共价键都有方向性
D.正三价阳离子的电子排布式为1s22s22p63s23p63d5的元素在周期表中位于Ⅷ族
查看答案和解析>>
科目:高中化学 来源: 题型:
下列推断正确的是( )
A.分子晶体中一定存在范德华力和共价键两种作用力,可能存在氢键
B.某晶体熔融态能导电,则一定是离子晶体
C.分子晶体、原子晶体、离子晶体、金属晶体都可以采用紧密堆积方式
D.金属元素形成的化合物可能是分子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布式为__ ____;一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______。
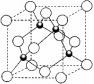 (2)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为__________。
(2)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为__________。
(3)Cu的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是 。
(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。

下列分子或离子中,能被该有机化合物识别的是_________(填标号)。
a. CF4 b. CH4 c. NH4+ d. H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
已知H2A在水中存在以下平衡:H2AH++HA-,HA-H++A2-。回答以下问题:
(1)NaHA溶液________(填“显酸性”、“显碱性”、“显中性”或“酸碱性无法确定”),原因是___________________________________________ _______________________________________________________________。
(2)某温度下,向0.1 mol·L-1的NaHA溶液中滴入0.1 mol·L-1 KOH溶液至中性,此时溶液中以下所示关系一定正确的是________。
A.c(H+)·c(OH-)=1×10-14
B.c(Na+)+c(K+)=c(HA-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)=0.05 mol·L-1
(3)已知常温下,H2A的钙盐(CaA)饱和溶液中存在平衡:CaA(s)Ca2+(aq)+A2-(aq) ΔH>0。
①温度升高时,Ksp________(填“增大”、“减小”或“不变”下同)。
②滴加少量浓盐酸,c(Ca2+)________,原因是__________________________ _____________________________________________________________________________________________(用文字和离子方程式说明)。
(4)若向CaA悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式__________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com