

���� ��1�����ݰ�����������ˮ����������
��2��b��Ӧ����������a���������������Ƴ�ֽӴ����ɴ������ƣ��������������ŵ磬���Դ������������
��3�����һ��ʱ���Ӧ�Ʊ�������ͨ�뵽C����������Ʒ�Ӧ��
��4���������۱���ɫ����ѡ�������ָʾ��������Һ����ɫ��Ϊ��ɫ���Ұ������ɫ���ٱ仯˵���ζ������յ㣻
��5���ɷ���ʽ��NH2Cl+3I-+2H2O�TNH3•H2O+OH-+Cl-+I3-��I3-�PI2+I-��I2+2S2O32-�T2I-+S4O62-�ɵõ���ϵʽ��NH2Cl��I3-��I2��2S2O32-���м��㣻
��� �⣺��1�����ݰ�����������ˮ��������������Bװ�õ�����Ϊ��ȫƿ��
�ʴ�Ϊ����ȫƿ��
��2��b��Ӧ����������a���������������Ƴ�ֽӴ����ɴ������ƣ��������������ŵ磬����b�����������Դ������������
�ʴ�Ϊ������
��3���ȵ��һ��ʱ���������ʵ�����ͨ���Ʊ�������ͨ�뵽C�У����ȴ�ֹˮ�У��ٴ�Һ©���Ļ�����
�ʴ�Ϊ���ȴ�ֹˮ�У��ٴ�Һ©���Ļ�����
��4���������۱���ɫ����ѡ�������ָʾ�����ж��ﵽ�ζ��յ�������ǵ���Һ����ɫ��Ϊ��ɫ���Ұ������ɫ���ٱ仯��
�ʴ�Ϊ����Һ����ɫ��Ϊ��ɫ���Ұ������ɫ���ٱ仯��
��5���ɷ���ʽ��NH2Cl+3I-+2H2O�TNH3•H2O+OH-+Cl-+I3-��I3-�PI2+I-��I2+2S2O32-�T2I-+S4O62-�����ɵõ���ϵʽ��NH2Cl��I3-��I2 ��2S2O32-��
1 2
C��NH2Cl����20��10-3L 0.100 mol•L-1��5��10-3L
��ã�C��NH2Cl��=$\frac{0.1000mol•{L}^{-1}��5��1{0}^{-3}L}{2��20��1{0}^{-3}L}$=0.0125mol•L-1
�ʴ�Ϊ��0.0125��
���� ���⿼����һ�Ȱ����Ʊ��뺬���IJⶨ��ע�����ʵ����ʡ�������ԭ��Ӧ�ζ���ԭ������㣬�ѶȲ���ע��ζ������ù�ϵʽ�ļ��㷽����Ҫϸ�ļ��㣬���׳�����


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
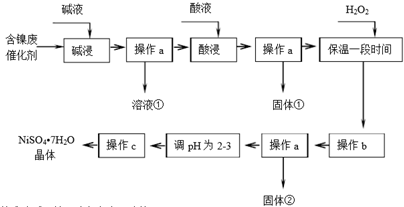
| ������ | Al��OH��3 | Fe��OH��3 | Fe��OH��2 | Ni��OH��2 |
| ��ʼ����pH | 3.8 | 2.7 | 7.6 | 7.1 |
| ��ȫ����pH | 5.2 | 3.2 | 9.7 | 9.2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ұ�������е�β�������������� | |
| B�� | ���������У���1molCuFeS2��ȡ1molCuʱ������2molO2 | |
| C�� | �ڷ�Ӧ2Cu2O+Cu2S�T6Cu+SO2���У�ֻ��Cu2O�������� | |
| D�� | ��⾫��ͭ�Ĺ����У�ÿת��1mol����ʱ�������ܽ�ͭ������Ϊ32g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
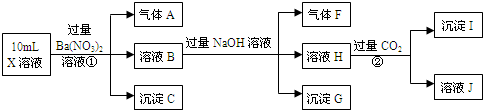
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
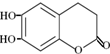 ���п������ã����й�������������������ȷ���ǣ�������
���п������ã����й�������������������ȷ���ǣ�������| A�� | ��Ҷ�������ķ���ʽΪC9H6O4 | B�� | �ɿ��ɷ����ֿɿ���������� | ||
| C�� | ����������Һ����������Ӧ | D�� | �������3mol Br2������Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���� | B�� | ������ | C�� | ����� | D�� | ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��Ϊ�˵õ���Ϊƽ�ȵ���Ȳ������װ��A�ķ�Һ©���г��ñ���ʳ��ˮ������ˮ��
��Ϊ�˵õ���Ϊƽ�ȵ���Ȳ������װ��A�ķ�Һ©���г��ñ���ʳ��ˮ������ˮ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
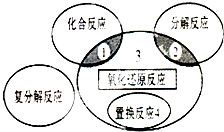
| A�� | 4Fe��0H��2+O2+2H2O�T4Fe��OH��3 | B�� | 2NaHCO3$\frac{\underline{\;\;��\;\;}}{\;}$Na2CO3+H2O+CO2�� | ||
| C�� | 4NH3+5O2$\frac{\underline{����}}{��}$4NO+6H2O | D�� | 2CuO+C$\frac{\underline{\;����\;}}{\;}$2Cu+CO2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 920 kJ | B�� | 557 kJ | C�� | 436 kJ | D�� | 188 kJ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com