
| A、通入稀有气体使压强增大,平衡将逆向移动 |
| B、C的正反应速率是A的逆反应速率的3倍 |
| C、降低温度,混合气体的平均相对分子质量减小 |
| D、移走部分C,C的体积分数减小 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、碳酸钙跟醋酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
| B、硫酸铝溶液中加过量氨水:Al3++3NH3?H2O═Al(OH)3↓+3NH4+ |
| C、向足量的溴化亚铁溶液中通入少量的氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
| D、碳酸氢钠溶液与足量的氢氧化钡溶液混合:Ba2++2OH-+2HCO3-═BaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
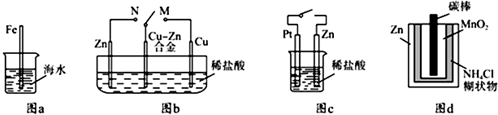
| A、图a中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
| B、图b中,开关由N改置于M时,Cu-Zn合金的腐蚀速率减小 |
| C、图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
| D、图d中,Zn-MnO2干电池自放电腐蚀体现了锌的还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 元素周期表中,金属和非金属分界线附近的元素性质特殊.其单质和化合物应用广
元素周期表中,金属和非金属分界线附近的元素性质特殊.其单质和化合物应用广3- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属易锈蚀能用金属的电子气理论加以解释 |
| B、化学式Si02能真实表示物质分子组成 |
| C、共价键、离子键和范德华力都是微粒之间的不同作用力,Na2O2、石墨、白磷均含有上述两种作用力 |
| D、CCl4与KCl晶体中,化学键种类相同,晶体类型也相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com