
【题目】分子中含有三个以上-OCH2CH2O-重复单元的有机物叫冠醚,18-冠-6的结构简式如图所示:

下列说法正确的是( )
A.18-冠-6中的“18”指分子含有18个碳原子,“6”指分子含有6个氧原子
B.该分子中所有原子可能共平面
C.该分子的一氯代物只有1种
D.该有机物的最简式和葡萄糖的相同
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】T℃时,三种盐的沉淀溶解平衡曲线如图所示,已知pM为阳离子浓度的负对数,pR为阴离子浓度的负对数,下列说法正确的是

A.Y点:![]() ,Z点:
,Z点:![]()
B.溶度积:Ksp(MnCO3)>Ksp(CaCO3)>Ksp(CaSO4)
C.X点对应的CaCO3溶液为不饱和溶液,可以继续溶解CaCO3
D.T℃时,![]() 的平衡常数K的数量级为103
的平衡常数K的数量级为103
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是用两个石墨作电极,电解饱和Na2SO4溶液的装置,U形管内的电解液中事先加有酚酞指示剂。回答下列问题:
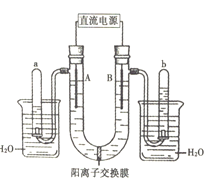
(1)根据图示中倒扣试管内的液面高度,判断直流电源左端为______极,Na+通过阳离子交换膜移动的方向为______(填“左→右”或“右→左”)。
(2)电解过程中,有关电极附近溶液颜色变化中正确的是______(填序号)。
①A管溶液由无色变为红色
②B管溶液由无色变为红色
③A管溶液不变色
④B管溶液不变色
(3)写出B管中发生的电极反应______。
(4)检验b管中气体的方法及现象是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z 为原子序数依次增大的短周期主族元素。元素W 分别与元素 X、Y、Z 结合形成质子数相同的甲、乙、丙三种分子。反应②是工业制硝酸的重要反应,乙与丙的混合物不能用玻璃瓶盛装。上述物质有如图所示的转化关系:
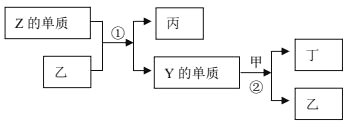
下列说法错误的是
A.甲是易液化气体,常用作致冷剂
B.可以用甲在一定条件下消除丁对环境的污染
C.甲、丙分子可以直接化合生成离子化合物
D.丁是一种红棕色气体,是大气主要污染物之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家在铁基超导研究方面取得了一系列的重大突破,标志着我国在凝聚态物理领域已经成为一个强国。LiZnAs 是研究铁基超导材料的重要前体。
(1)LiZnAs 中三种元素的电负性从小到大的顺序为_____。
(2)AsF3 分子的空间构型为_____,As 原子的杂化轨道类型为_____。
(3)CO 分子内因配位键的存在,使 C 原子上的电子云密度较高而易与血红蛋白结合, 导致 CO 有剧毒。1mol[Zn(CN)4]2-离子内含有的共价键的数目为_____,配原子为_____。
(4)镍的氧化物常用作电极材料的基质。纯粹的 NiO 晶体的结构与 NaCl 的晶体结构相同,为获得更好的导电能力,将纯粹的 NiO 晶体在空气中加热,使部分 Ni2+被氧化成 Ni3+后, 每个晶胞内 O2-的数目和位置均未发生变化,镍离子的位置虽然没变,但其数目减少,造成晶体内产生阳离子空位(如图所示)。化学式为 NiO 的某镍氧化物晶体,阳离子的平均配位数为__________,阴离子的平均配位数与纯粹的 NiO 晶体相比____________(填“增大”“减小”或“不变””,写出能体现镍元素化合价的该晶体的化学式________示例:Fe3O4 写作 Fe2+Fe23+O4)。

(5)所有的晶体均可看作由某些微粒按一定的方式堆积,另外的某些微粒填充在上述堆 积所形成的空隙中。在面心立方紧密堆积的晶胞中存在两种类型的空隙:八面体空隙和四面体空隙(如下左图所示)。在 LiZnAs 立方晶胞中,Zn 以面心立方形式堆积,Li 和 As 分别填充在 Zn 原子围成的八面体空隙和四面体空隙中,在 a=0,0.5 和 1 三个截面上 Zn 和 Li 按下图所示分布:请在下图 As 原子所在的截面上用“Δ”补画出 As 原子的位置,______________并说明 a=__________。


查看答案和解析>>
科目:高中化学 来源: 题型:
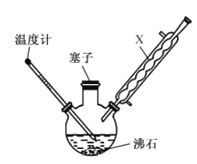
【题目】某同学在实验室以苯胺(密度:1.02g.mL—1)和浓硫酸为原料制备对氨基苯磺酸(![]() ),反应原理以及反应装置(加热及夹持仪器已省略)如下:
),反应原理以及反应装置(加热及夹持仪器已省略)如下:
![]() +H2SO4(浓)
+H2SO4(浓)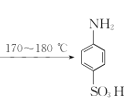 +H2O
+H2O
已知:100mL水在20C时可溶解对氨基苯磺酸1.08g,在100C时可溶解6.67g 。实验步骤:
I.在100mL三颈烧瓶中加入10mL苯胺及几粒沸石,将三颈烧瓶放入冷水中冷却,小心地加入20mL浓硫酸;
II.将三颈烧瓶置于加热装置中缓慢加热至170~180℃,维持此温度2~2.5h;
III.将反应液冷却至约50℃后,倒入盛有100mL冷水的烧杯中,用玻璃棒不断搅拌,促使晶体析出,抽滤,用少量冷水洗涤,得到对氨基苯磺酸粗产品;
VI.将粗产品用沸水溶解,冷却结晶,抽滤,收集产品,晾干得到16.2g对氨基苯磺酸。
回答下列问题:
(1)装置中,x的名称为______________ ,其作用是__________________ 。
(2)步骤II中,“加热装置”是 ________ (填“油浴”或“水浴”)装置。
(3)步骤III中,需用少量冷水洗涤对氨基苯磺酸粗产品的原因是________________ 。
(4)步骤VI,冷却结晶过程中,若溶液颜色过深,可用__________(填一种吸附剂)脱色。
(5)本实验中对氨基苯磺酸的产率为__________(结果保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿是一种铜铁硫化物,化学式为CuFeS2,它是工业上炼铜的主要原料。某化学小组对其中的硫、铁、铜的含量进行测定。
Ⅰ.硫的含量测定。
(1)采用装置A,在高温下将10.0g矿样中的硫转化为SO2。
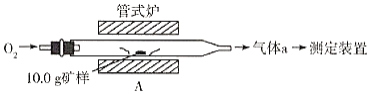
若在装置A反应中,氧化剂与还原剂的物质的量之比为19:6,灼烧后A中留下黑色固体,则反应的化学方程式为__________。
(2)将气体a通入测硫装置中(如图),然后采用沉淀法测定硫的含量。

①KMnO4溶液氧化SO2的离子方程式为________________。
②向反应后的溶液中加入过量的BaCl2溶液,过滤,洗涤沉淀并干燥,称重为23.3g,则该矿样中硫的质量分数为__________。
Ⅱ.铁、铜的含量测定。
向A中灼烧后的固体中加入稀硫酸,加热溶解,过滤,将滤液分为两等份。
(3)取其中一份加入过量的氨水生成沉淀{已知Cu(OH)2能溶于氨水生成[Cu(NH3)4]2+},过滤、洗涤、灼烧、称重为1.5 g。实验过程中,加入过量的氨水得到的沉淀是___________(填化学式);灼烧时除用到三脚架、酒精灯和玻璃棒外,还要用到________________。
(4)①将另一份溶液调至弱酸性,先加入NH4F,使Fe3+生成稳定的![]() ,其目的是_____
,其目的是_____
②加入过量KI溶液,使Cu2+生成CuI沉淀,同时析出定量的I2。
③再用1.00 molL-1 Na2S2O3标准溶液滴定生成的I2,以___________作指示剂。若消耗的Na2S2O3标准溶液为25.00 mL,则矿样中铜的质量分数是_________(已知I2 +2 Na2S2O3= Na2S4O6+2NaI)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2SO2(g)+O2(g)=2SO3(g)△H=-196.6kJ/mol,在温度、容积均相同的 3 个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下表所示:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1mol O2、2mol SO2 | 2mol SO3 | 1mol SO3 |
SO3的浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
体系压强(Pa) |
|
|
|
反应物转化率 | α1 | α2 | α3 |
下列说法不正确的是
A.c1>2c3B.a+b=196.6
C.p2>2p3D.α1+α3>1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生的实验报告中,描述合理的是( )
A.用量筒量取25.20mL的稀盐酸
B.用pH试纸测得NaClO溶液的pH约为11
C.将CuCl2溶液蒸发浓缩、降温结晶、过滤得到氯化铜晶体
D.用25mL酸式滴定管量取出15.00mLKMnO4溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com