
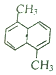
 ,其苯环上的二溴代物有9种,苯环上的四溴代物有9种.
,其苯环上的二溴代物有9种,苯环上的四溴代物有9种. 分析 先根据等效氢找一溴代物, 共有3种一溴代物,然后一溴代物中氢原子的种类可得二溴代物;用换元法解答,苯环上的四溴代物可以看作苯环六溴代物其中2个溴原子被2个H原子取代,故二溴代物与四溴代物同分异构体数目相同,以此解答该题.
共有3种一溴代物,然后一溴代物中氢原子的种类可得二溴代物;用换元法解答,苯环上的四溴代物可以看作苯环六溴代物其中2个溴原子被2个H原子取代,故二溴代物与四溴代物同分异构体数目相同,以此解答该题.
解答 解: 分子中含有3种氢原子,有3种一溴代物:
分子中含有3种氢原子,有3种一溴代物: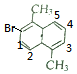 、
、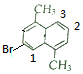 、
、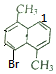 ,
,
一溴代物为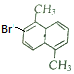 时,二溴代物有5种,如图所示:
时,二溴代物有5种,如图所示: ;
;
一溴代物为 时,二溴代物有3种,如图所示:
时,二溴代物有3种,如图所示: ;
;
一溴代物为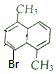 时,二溴代物有1种,如图所示:
时,二溴代物有1种,如图所示: ;
;
所以苯环上的二溴代物共有9种;
苯环上的四溴代物可以看作苯环六溴代物其中2个溴原子被2个H原子取代,故四溴代物与二溴代物同分异构体数目相同,由于二溴代物有9种同分异构体,故四溴代物的同分异构体数目也为9种;
故答案为:9;9.
点评 本题考查同分异构数目的判断,侧重于学生的分析能力的考查,难度中等,注意换元法的利用,芳香烃的苯环上有多少种可被取代的氢原子,就有多少种取代产物,若有n个可被取代的氢原子,那么m个取代基(m<n)的取代产物与(n-m)个取代基的取代产物的种数相同.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 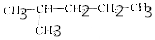 和 和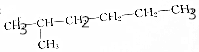 | |
| B. | 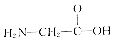 和CH3-CH2-NO2 和CH3-CH2-NO2 | |
| C. | CH3-CH2-CH2-COOH和CH3-CH2-CH2-CH2-COOH | |
| D. | CH3-CH2-O-CH2-CH3和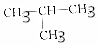 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 通入HCl气体之前:c(S2-)>c(HS-)>c(OH-)>c(H+) | |
| B. | pH=7的溶液中:c(Cl-)═c(HS-)+2c(H2S) | |
| C. | c(HS-)=c(S2-)的碱性溶液中:c(Cl-)+c(HS-)>0.100 mol•L-1+c(H2S) | |
| D. | c(Cl-)=0.100 mol•L-1的溶液中:c(OH-)-c(H+)=c(H2S)-c(S2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
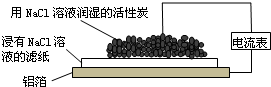
| A. | 铝箔为正极,发生氧化反应而被腐蚀 | |
| B. | 负极反应为2H2O+O2+4e-═4OH- | |
| C. | Cl-由活性炭区向铝箔表面区迁移,铝箔表面有氯气产生 | |
| D. | 白斑的主要成分可能是Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用过量氨水吸收工业尾气中的SO2:NH3•H2O+SO2═NH4++HSO3- | |
| B. | 氯化钠固体与浓硫酸混合加热:2H++H2SO4+2Cl-$\frac{\underline{\;△\;}}{\;}$SO2↑+Cl2↑+2H2O | |
| C. | 氧化亚铁溶于稀硝酸:3 Fe2++4H++NO3-═3Fe3++NO↑+2H2O | |
| D. | 0.01 mol•L-1 NH4Al(SO4)2溶液与0.02 mol•L-1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com