
【题目】在一压强始终与外界大气压相同的密闭容器中,将适量硫粉和碳粉的混合物与一定量的O2完全反应,恢复到常温,放出504.875kJ的热量,反应后O2有剩余。在标准状况下测得反应后混合气体的体积为44.8L,已知反应后的混合气体中某种气体(A)的质量与物质的量均为另两种气体之和,且C(s)+O2(g) = CO2(g) ΔH=-393.5kJ/mol-1。
(1)投入O2的总体积在标准状况下的体积为____________L。
(2)A为_________。
A.SO2 B.CO2 C.O2 D.无法确定
(3)反应后混合气体的平均摩尔质量为__________________。
(4)混合气体中![]() =_____________。
=_____________。
(5)表示硫燃烧热的热化学方程式为_____________________________________________。
【答案】44.8 B 44g/mol 8:3 S(s) + O2(g) = SO2(g) △H= -297.0kJ/mol
【解析】
(1)C(s)+O2(g)═CO2(g)、S(s)+O2(g)═SO2(g)均为反应前后气体体积不变的反应,反应后气体体积等于氧气的体积,标准状况下测得反应后混合气体的体积为44.8L,则氧气体积为44.8L,故答案为:44.8;
(2)C(s)+O2(g)═CO2(g)、S(s)+O2(g)═SO2(g)中,n(混合气体)=2mol,三种气体中SO2的摩尔质量最大,氧气的摩尔质量最小,二氧化碳的摩尔质量介于二者之间,A的质量与物质的量均为另两种气体之和,即n(A)=n(B)+n(C),且m(A)=m(B)+m(C),![]() ,A的摩尔质量为B、C两者的平均摩尔质量,即A的摩尔质量在二者之间,则A为CO2,
,A的摩尔质量为B、C两者的平均摩尔质量,即A的摩尔质量在二者之间,则A为CO2,
故答案为:B;
(3)混合气体的物质的量为2mol,A的质量与物质的量均为另两种气体之和,A为CO2,则混合气体的质量为44g+44g=88 g,则M=![]() =44g/mol,
=44g/mol,
故答案为:44g/mol;
(4)设剩余氧气为xmol,生成二氧化硫为ymol,
则![]() ,解得x=
,解得x=![]() mol,y=
mol,y=![]() mol混合气体中
mol混合气体中![]() =1mol:y=1mol:
=1mol:y=1mol:![]() mol=8:3,
mol=8:3,
故答案为:8:3;
(5)生成![]() mol二氧化硫放出热量为504.875kJ393.5kJ =111.375kJ,则生成1mol二氧化硫放出热量为111.375kJ×
mol二氧化硫放出热量为504.875kJ393.5kJ =111.375kJ,则生成1mol二氧化硫放出热量为111.375kJ×![]() =297kJ,则热化学方程式为S(s)+O2(g)═SO2(g)△H=297kJ/mol;
=297kJ,则热化学方程式为S(s)+O2(g)═SO2(g)△H=297kJ/mol;
故答案为:S(s)+O2(g)═SO2(g)△H=297kJ/mol。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列萃取与分液结合进行的操作(用![]() 作萃取剂,从碘水中萃取磺)错误的是( )
作萃取剂,从碘水中萃取磺)错误的是( )
A.碘水和![]() 加入分液漏斗后,盖好玻璃塞,右手压住分液漏斗口部,左手握住活塞部分,把分液漏斗倒转过来振荡
加入分液漏斗后,盖好玻璃塞,右手压住分液漏斗口部,左手握住活塞部分,把分液漏斗倒转过来振荡
B.静置,待分液漏斗中液体分层后,先使分液漏斗内外空气相通(准备放出液体)
C.打开分液漏斗的活塞,使下层液体全部沿盛接液体的烧杯内壁慢慢流出
D.最后继续打开活塞,另用容器盛接并保存上层液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:P4(s)+6Cl2(g)=4PCl3(g) ΔH=akJ·mol-1
P4(s)+10Cl2(g)=4PCl5(g) ΔH=bkJ·mol-1
P4具有正四面体结构,PCl5中P-Cl键的键能为ckJ·mol-1,PCl3中P-Cl键的键能为1.2ckJ·mol-1
下列叙述正确的是( )
A.P-P键的键能大于P-Cl键的键能
B.可求Cl2(g)+PCl3(g)=PCl5(s)的反应热ΔH
C.Cl-Cl键的键能![]() kJ·mol-1
kJ·mol-1
D.P-P键的键能为![]() kJ·mol-1
kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
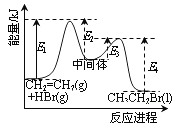
A. 分子式为C2H4O的有机化合物性质相同
B. 同温同压下,同体积的任何气体均含有相同的原子数
C. 密闭容器中1molN2与3molH2充分反应,产物的分子数为 2×6.02×1023
D. 依据右图能量曲线可确定反应:CH2=CH2(g)+HBr(g)→CH3CH2Br(l)的![]() H= (E1+E3-E2-E4)kJ·mol-1
H= (E1+E3-E2-E4)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y和Z为原子序数依次增大的四种短周期元素。X是短周期原子半径最大的元素,Y的最高化合价与最低价相加为0,Z是同周期非金属性最强的元素,W、X、Y三种元素形成的一种化合物结构如图所示。下列叙述正确的是
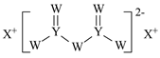
A.X单质的熔点高于Y单质
B.气态氢化物稳定性:Y<Z
C.Z的氧化物对应的水化物为强酸
D.X分别与W、Z形成的二元化合物溶于水显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将硫酸铜的稀溶液放在密闭容器中,缓缓抽去容器中的水蒸气,溶液逐渐失水变成饱和溶液,再继续抽气,则变成各种含水盐,最后变成无水硫酸铜。50℃时,容器中的压强与晶体水合物中含水量的关系如图所示,下列说法错误的是
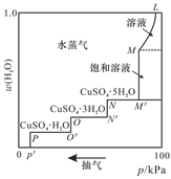
A.曲线L-M对应溶液中无硫酸铜晶体析出
B.曲线M-M对应溶液溶质的质量分数保持不变
C.曲线M- N对应体系存在平衡:CuSO4(饱和溶液)![]() CuSO4·5H2O(s)+H2O(g)
CuSO4·5H2O(s)+H2O(g)
D.当容器中压强低于p后得到无水硫酸铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在有关限定条件下溶液中一定能大量共存的是( )
A. 由水电离产生的c(H+)=10-12mol/L的溶液中:K+、Na+、ClO-、I-
B. c(H+)=![]() mol/L的溶液中:K+、Fe3+、Cl-、CO32—
mol/L的溶液中:K+、Fe3+、Cl-、CO32—
C. 常温下,![]() =1×10-12的溶液:K+、AlO2—、CO32—、Na+
=1×10-12的溶液:K+、AlO2—、CO32—、Na+
D. pH=13的溶液中:AlO2—、Cl-、HCO3—、SO42—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,在c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol·L-1的H2C2O4、NaOH混合溶液中,含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示。下列说法正确的是( )

A. 0.100 mol·L-1NaHC2O4溶液中:c(OH-)=c(H+)-2c(C2O42-)+c(H2C2O4)
B. Q点:c(H2C2O4)+c(C2O42-)>c(HC2O4-)
C. P点:c(Na+)+c(H2C2O4)<0.100mol·L-1+c(C2O42-)
D. 该温度下H2C2O4的电离常数Ka2=1×10-4.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某温度时,将 n mol·L-1氨水滴入 10 mL 1.0 mol·L-1盐酸中,溶液 pH 和温度随加入氨水体积变化曲线如图所示。下列有关说法错误的是
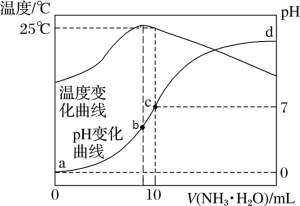
A.c 点存在守恒关系:c(NH4+)=c(Cl-)
B.b 点:c(Cl-)> c(NH4+)>c(H+)>c(OH-)
C.水的电离程度:b > c > a > d
D.25℃时 ,NH4Cl 水解平衡常数为(n-1)×10-7(用 n 表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com