
| A. | Na2SiO3溶液中滴加适量稀HCl制硅酸胶体:SiO32-+2H+═H2SiO3(胶体) | |
| B. | 用稀HNO3清洗试管壁上的银镜:3Ag+4H++NO3-═3Ag++NO↑+2H2O | |
| C. | (NH4)2SO4溶液与过量Ba(OH)2溶液混合:NH4++SO42-+Ba2++OH-═BaSO4↓+NH3•H2O | |
| D. | SO2通入氯水中:Cl2+SO2+2H2O═SO42-+2Cl-+4H+ |
分析 A.硅酸钠与稀盐酸反应生成硅酸胶体和氯化钠;
B.稀硝酸具有强氧化性,能够与银反应生成硝酸银、一氧化氮和水;
C.氢氧化钡过量,铵根离子完全反应,铵根离子的系数错误;
D.二氧化硫与氯气发生氧化还原反应生成硫酸和氯化氢.
解答 解:A.硅酸钠溶液中滴加适量稀HCl,反应生成硅酸和氯化钠,反应的离子方程式为:SiO32-+2H+═H2SiO3(胶体),故A正确;
B.用稀HNO3清洗试管壁上的银镜,银与稀硝酸发生氧化还原反应,反应的离子方程式为:3Ag+4H++NO3-═3Ag++NO↑+2H2O,故B正确;
C.(NH4)2SO4溶液与过量Ba(OH)2溶液混合,反应生成硫酸钡和一水合氨,正确的离子方程式为:2NH4++SO42-+Ba2++2OH-═BaSO4↓+2NH3•H2O,故C错误;
D.二氧化硫通入氯水中,二氧化硫被氧化成硫酸,反应的离子方程式为:Cl2+SO2+2H2O═SO42-+2Cl-+4H+,故D正确;
故选C.
点评 本题考查了离子方程式的判断,为高考中的高频题,属于中等难度的试题,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:解答题
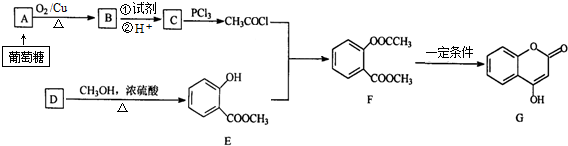
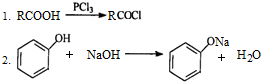
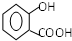 .
.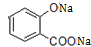 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验装置 | 实验目的 |
| A | 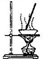 | 加热硫酸铜晶体获得无水硫酸铜 |
| B | 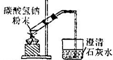 | 加热碳酸氢钠,证明它能分解释放出二氧化碳气体 |
| C | 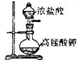 | 实验室制取氯气 |
| D | 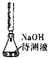 | 用中和滴定的方法测定某氢氧化钠待测液的浓度 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Fe(NO3)2和KI混合溶液中加入少量稀盐酸:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ | |
| B. | 向硝酸银溶液中加入足量的氨水:Ag++2NH3•H2O═Ag(NH3)2++2H2O | |
| C. | 泡沫灭火器的灭火原理:2Al3++3CO32-+3H20═2Al(OH)3↓+3CO2↑ | |
| D. | 用足量的氨水处理硫酸工业的尾气:SO2+NH3•H2O═NH4++HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al14有42个价电子,且与IIA族元素性质相似 | |
| B. | Al13有39个价电子,且与卤素性质类似 | |
| C. | Al13在气相中与HI反应可生成HAl13I,且化学方程式为 Al13+HI=HAl13I | |
| D. | Al13原子中A1原子间是通过离子键结合的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 双氧水是一种对环境友好的消毒剂、漂白剂,广泛应用于化工、医药、环保等领域.请回答下列问题:
双氧水是一种对环境友好的消毒剂、漂白剂,广泛应用于化工、医药、环保等领域.请回答下列问题: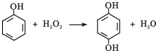 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
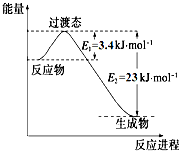 研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.| 实验组[ | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油裂解的主要目的是提高汽油等轻质油的产量与质量,石油催化裂化的主要目的是得到更多的乙烯、丙烯等气态短链烃 | |
| B. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管 | |
| C. | 汽车尾气催化转化装置可将尾气中的NO和CO等有害气体转化为N2和CO2,该装置中的催化剂可降低NO和CO反应的活化能,有利于提高该反应的平衡转化率 | |
| D. | 近期在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化亚铁能与酸反应,可用于制作红色涂料 | |
| B. | 在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀 | |
| C. | 碘是人体必需的微量元素,所以要多吃富含高碘酸的食物 | |
| D. | 维生素C是水溶性维生素,能增强人体抵抗力,有解毒作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com