
【题目】钛是一种现代工业应用广泛的优良金属,使用量可能会超过金属铁。工业上冶炼金属钛的方法有多种,下列反应原理是比较常见的冶炼钛的一种方法:
①TiO2+2Cl2 +2C![]() TiCl4+2CO;②TiCl4+2Mg
TiCl4+2CO;②TiCl4+2Mg ![]() Ti+2MgCl2。
Ti+2MgCl2。
请回答下列问题:
(1)与钛同周期元素中未成对电子数最多的基态原子的电子排布式为_________________。
(2)反应①中涉及的非金属元素电负性由大到小的顺序为_________(用元素符号表示);与CO互为等电子体的离子为__________(填化学式,写一种即可)。
(3)①TiCl4在常温下是无色液体,分子中4 个氯原子不在一个平面上,TiCl4空间构型为____,该物质能否溶解在苯溶剂中__________(填“能”或“否”) 。
②三氯化钛与酒石酸(![]() )反应,制得新的固态配合物酒石酸羟基钛(III)[Ti(OH)(C4H4O6)·1.5H2O),在酒石酸中,羧基氧原子的轨道杂化类型分别是_______,σ键和π键的数目比为__________,Ti3+能形成配合物的原因为____________。1个酒石酸分子中手性碳原子数有_____________个。
)反应,制得新的固态配合物酒石酸羟基钛(III)[Ti(OH)(C4H4O6)·1.5H2O),在酒石酸中,羧基氧原子的轨道杂化类型分别是_______,σ键和π键的数目比为__________,Ti3+能形成配合物的原因为____________。1个酒石酸分子中手性碳原子数有_____________个。
(4)钛酸钡晶体的结构示意图如图所示,若晶胞参数为a pm,则钛酸钡晶体的密度=_____g/cm3(阿伏加德罗常数用NA表示)。

【答案】 1s22s22p63s23p63d54s1或[Ar]3d54s1 O>Cl>C CN-(或NO+、C22-) 正四面体 能 sp2、sp3 15 :2 Ti3+具有空轨道 2 233/[NA·(a×10-10)3]
【解析】(1)钛为第4周期元素,同周期元素中未成对电子数最多的基态原子的3d和4s均为半充满,电子排布式为1s22s22p63s23p63d54s1或[Ar]3d54s1,故答案为:1s22s22p63s23p63d54s1或[Ar]3d54s1;
(2)反应①中涉及的非金属元素有C、O、Cl,元素的非金属性越强,电负性的数值越大,电负性由大到小的顺序为O>Cl>C;与CO互为等电子体的离子CN-或C22-,故答案为:O>Cl>C;CN-(或C22-等);
(3)①TiCl4分子中4个氯原子不在一个平面上,TiCl4空间构型为正四面体;TiCl4分子中正负电荷分布均匀,是非极性分子,根据相似相容原理,该物质能溶于苯,故答案为:正四面体;能;
②在酒石酸(![]() )中,羧基上的氧原子有2种,其中碳氧双键中的O的价层电子对数目=3,采用sp2杂化,羟基上的O的价层电子对数目=4,采用sp3杂化;单键为1个σ键,双键为1个σ键和1个π键,酒石酸(
)中,羧基上的氧原子有2种,其中碳氧双键中的O的价层电子对数目=3,采用sp2杂化,羟基上的O的价层电子对数目=4,采用sp3杂化;单键为1个σ键,双键为1个σ键和1个π键,酒石酸(![]() )中σ键和π键的数目比为15:2;Ti3+具有空轨道,[Ti(OH)(C4H4O6)·1.5H2O)中的配体中的O原子含有孤对电子,能够与Ti原子形成配位键;手性碳原子一定是饱和碳原子,手性碳原子所连接的四个基团要是不同,1个酒石酸(
)中σ键和π键的数目比为15:2;Ti3+具有空轨道,[Ti(OH)(C4H4O6)·1.5H2O)中的配体中的O原子含有孤对电子,能够与Ti原子形成配位键;手性碳原子一定是饱和碳原子,手性碳原子所连接的四个基团要是不同,1个酒石酸(![]() )分子中含有2个手性碳原子(
)分子中含有2个手性碳原子(![]() ),故答案为:sp2、sp3;15:2;Ti3+具有空轨道;2;
),故答案为:sp2、sp3;15:2;Ti3+具有空轨道;2;
(4)根据钛酸钡晶体的结构示意图可知,晶胞中含有Ti原子的数目=8×![]() =1,O原子的数目=12×
=1,O原子的数目=12×![]() =3,Ba原子的数目=1,化学式为BaTiO3,则钛酸钡晶体的密度=
=3,Ba原子的数目=1,化学式为BaTiO3,则钛酸钡晶体的密度= =
= g/cm3,故答案为:
g/cm3,故答案为:  。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】法国、美国、荷兰的三位科学家因研宄“分子机器的设计与合成”获得2016年诺贝尔化学奖。轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )

A. 该化合物的名称为乙酸乙酯
B. 该化合物与Br2的四氯化碳溶液不反应
C. 该化合物既能发生水解反应,又能发生氧化反应
D. 该化合物的同分异构体中,能与NaHCO3反应放出CO2的只有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.75%的酒精可使蛋白质变性,常用于杀菌消毒
B.氨基酸为高分子化合物,分子中含有-COOH和-NH2
C.往淀粉水解液中加入过量NaOH溶液,再加入碘水,未变蓝色,则说明淀粉已完全水解
D.油脂在碱性条件下水解生成高级脂肪酸和甘油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组欲从工业废钒催化剂中回收V2O5,通过分析知该废钒催化剂的主要成分如下表:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~29 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
他们通过查阅资料找到一种废钒催化剂的回收工艺流程路线如下:

回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,V2O4转成VO2+。则“废渣1”的主要成分是_____________。
(2)“氧化”的目的是使VO2+变为VO2+,写出该反应的离子方程式________________________。
(3)“中和”作用之一是使钒以V4O124-形式存在于溶液中,则“废渣2”的成分有__________(用化学式表示)。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124- ![]() R4V4O12+4OH-(ROH为強碱性阴离子交换树脂)。“流出液”中阳离子最多的是_______________;为了提高洗脱效率,淋洗液应该呈______性(填“酸”、“碱“或“中”)。
R4V4O12+4OH-(ROH为強碱性阴离子交换树脂)。“流出液”中阳离子最多的是_______________;为了提高洗脱效率,淋洗液应该呈______性(填“酸”、“碱“或“中”)。
(5)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出得到沉定的化学方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由氮的化合物引起的环境污染称为氮污染。
(1)己知CO将NO转化为N2的方程式为2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH,某研究小组在实验中研究温度对NO转化率的影响并绘制图像。
N2(g)+2CO2(g) ΔH,某研究小组在实验中研究温度对NO转化率的影响并绘制图像。
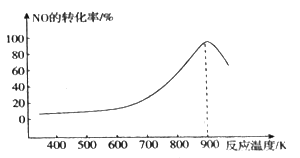
①当n(NO)/n(CO)=l,容器容积恒定时,在不同温度下反应相同的时间测得NO的转化率变化如图所示,则在此反应时间内应控制反应的最佳温度在______左右,该反应的ΔH_____0 (填>或<)。
②该反应的平衡常数表达式为K=__________。
要同时提高平衡常数的值和NO的平衡转化率,可采取的措施是________。
A.降低温度 B.及时将CO2和N2从反应体系中移走
C.升高温度 D.增大压强
③在恒温恒容容器中按体积比2∶1充入CO和NO的混合气体,下列选项能说明正反应速率大于逆反应速率的是_____________(填序号)。
A.CO的浓度保持恒定 B.混合气体的平均相对分子质量逐渐减小
C.CO和NO的物质的量之比逐渐增大 D.CO、NO、N2的速率之比为2∶2∶1
(2)在催化剂存在的条件下,用H2可以将NO还原为N2,己知:

则氢气和一氧化氮反应生成氮气和水蒸气的热化学方程式是_________________。
(3)MAP沉淀法是一种比较新颖有效的处理氨氮废水的方法,.原理如下:向含NH4+的废水中投加磷酸盐和镁盐,使之和NH4+生成难溶复盐MgNH4PO4·6H2O (简称MAP)。MAP沉淀法需要控制反应的PH在7.5-10之间,当PH过高时不利于生成MAP的原因是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol CH4和适量O2在密闭容器中混合点燃,充分反应后CH4和O2均无剩余,且产物均为气体,质量为72 g。下列叙述正确的是
A. 若将产物通过碱石灰,则可全部被吸收;若通入浓硫酸,则不能完全被吸收
B. 产物的平均摩尔质量为20 g·mol-1
C. 若将产物通过浓硫酸后恢复至室温,压强变为原来的1/2
D. 反应中消耗O256 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA为阿伏加德罗常数的值,请回答下列问题:
(1)已知氨气的相对分子质量为17,则氨气的摩尔质量为__________。
(2)已知一个铁原子的质量为bg,则铁原子的摩尔质量为____________。
(3)已知ag某气体中含分子数为b,则该气体的摩尔质量为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com