
【题目】在25℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液.观察到的现象是先出现黄色沉淀.最终出现黑色沉淀.已知有关物质的溶度积Ksp(25℃)如下:下列叙述错误的是( )
AgCl | AgI | Ag2S | |
Ksp | 1.8×10﹣10 | 8.51×10﹣16 | 6.3×10﹣50 |
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度相同
D.25℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同
【答案】C
【解析】解:A、沉淀转化的实质就是由难溶物质转化为更难溶的物质,故属于沉淀溶解平衡的移动,故A正确;
B、对于相同类型的难溶性盐,一般情况下溶度积大的沉淀较易转化成溶度积小的沉淀,如向AgCl的白色悬浊液中加入KI溶液,可生成AgI沉淀,故B正确;
C、由于溶度积是常数,故氯离子浓度大,则银离子浓度小,故C错误;
D、饱和AgCl、AgI、Ag2S溶液中Ag+的浓度分别为: ![]() ≈1×10﹣5mol/L、
≈1×10﹣5mol/L、 ![]() ≈3×10﹣8mol/L、
≈3×10﹣8mol/L、 ![]() ≈2×10﹣16mol/L,Ag+的浓度不同,故D正确,故选C.
≈2×10﹣16mol/L,Ag+的浓度不同,故D正确,故选C.
A、依据平衡移动原理回答即可;
B、对于相同类型的难溶性盐,一般情况下溶度积大的沉淀较易转化成溶度积小的沉淀;
C、依据同离子效应判断即可;
D、根据溶度积计算Ag+的浓度.


科目:高中化学 来源: 题型:
【题目】在下列中学化学中常见物质的转化关系图中,已知常温下A为淡黄色固体化合物、B为金属单质,D、E、M是常见气体单质,其中I为红褐色固体,M为黄绿色,N是胃酸的主要成分,工业上用E和M来制取N,试推断:
(1)写出下列化学式AI
(2)G转化为I的现象为
(3)F+M→H离子方程式为
(4)A+X→C+D的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氯化钠溶液、Fe(OH)3胶体和泥水三种分散系,下列叙述正确的是
A.Fe(OH)3胶体能产生丁达尔效应
B.最稳定的分散系是Fe(OH)3胶体
C.氯化钠溶液和Fe(OH)3胶体中的分散质都能透过半透膜
D.Fe(OH)3胶体的分散质粒子直径均小于1nm
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl晶体微溶于水和稀硫酸,不溶于乙醇,但易溶于浓盐酸和氯化铵溶液,发生的反应为:CuCl+Cl-![]() CuC12,且其见光易分解,露置于潮湿空气中易被氧化。回答下列问题:
CuC12,且其见光易分解,露置于潮湿空气中易被氧化。回答下列问题:
(1)实验室保存新制CuCl晶体的方法是__________。
(2)向硫酸铜溶液中加入亚硫酸铵和氯化铵,会发生反应生成CuCl。
①该反应的离子方程式为_____________。
②(NH4)2SO3要适当过量,目的为保证Cu2+的还原速率、_____________。
③已知Cu2+的沉淀率与NH4Cl、CuSO4的物质的量之比[n(NH4Cl)/n(CuSO4)]的关系如图甲所示,当氯化铵用量增加到一定程度后,Cu2+的沉淀率减小,原因是_______________。

(3)已知:CuCl固体、CuOH固体分别为白色和橙黄色,且Ksp(CuCl)=1.2×10-6,Ksp(CuOH)=1.2×10-14。用铜电极电解饱和食盐水的装置如图乙所示,阳极的电极反应式为Cu-e-+Cl-=CuCl。则实验过程中的实验现象为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒的原子序数为34,是硫的同主族元系,硒的单质及其化合物用途非常广泛。
(1)硫的原子结构示意图为_____________。
(2)Se2Cl2常用作分析试剂,其电子式为_____________。
(3)硒化铟是一种可应用于未来超算设备的新型半导体材料。已知铟(In)与铝同族且比铝多两个电子层。下列说法正确的是___________(填字母)。
A. In的金属性比A1弱 B.原子半径:In>Se
C.In的金属性比Se强 D.硒化铟的化学式为InSe2
(4)工业上常从电冶铜的阳极泥中提取纳米硒。向浆化的阳极泥中通入氯气,Cu2Se被溶液中的HC1O氧化为H2SeO3 及CuCl2,当生成1molH2SeO3时,消耗HClO的物质的量为______mol。用氨水中和亚硒酸后得到亚硒酸铵,再向(NH4)2SeO3溶液中加入Na2SeO3可得到纳米硒,同时生成亚硫酸盐,(NH4)2SeO3与Na2S2O3反应生成纳米硒的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四元轴烯 t、苯乙烯 b 及立方烷 c 的分子式均为 C8H8。下列说法正确的是
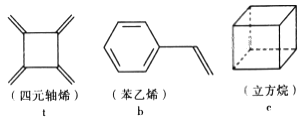
A. b 的同分异构体只有 t 和 c 两种
B. t、b、c 的二氯代物均只有三种
C. t 和b 能使酸性 KMnO4 溶液褪色而c 不能
D. t、b、c 中只有 t 的所有原子处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是( )
A. 在标况下,11.2 L NO与11.2 L O2 混合后所含分子数为 0.75NA
B. 常温常压下16 g O3 所含的电子数为 8NA
C. 1 mol N2 一定条件下与足量的 H2 反应合成氨气转移的电子数为 6NA
D. 在 0.1 mol·L-1 K2CO3 溶液中,阴离子数目大于 0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象及得出的结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向盛有品红的两只试管中分别通入SO2和Cl2 | 品红均褪色 | 两者漂白原理相同 |
B | 向体积相同且pH均为3.3的一元酸HX和HY中分别加入足量锌粒 | 产生的H2前者比后者多 | HX、HY均是弱酸 |
C | 在难溶性FeS和CuS中分别加入0.3mol/L盐酸 | 前者溶解,后者不溶 | Ksp(FeS)>Ksp(CuS) |
D | 向盛有相同体积、10%H2O2溶液的两只试管中分别加入足量酸性KMnO4溶液和FeCl3溶液 | 前者产生的气体多 | KMnO4催化活性比FeCl3高 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L恒容密闭容器中充入A(g)和B(g),发生反应A(g)+B(g) ![]() 2C(g)+D(s),所得实验数据如下表:
2C(g)+D(s),所得实验数据如下表:
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(A) | n(B) | n(C) | ||
① | 600 | 0.30 | 0.20 | 0.30 |
② | 700 | 0.20 | 0.30 | 0.24 |
③ | 800 | 0.10 | 0.10 | a |
下列说法不正确的是
A. 实验①中,若5min时测得n(B)=0.050mol,则0至5min时间内平均反应速率v(A)=0.015mol/(L·min)
B. 实验②中达到平衡后,增大压强,A的转化率不变,平衡常数不变
C. 700℃时该反应的平衡常数K=4.0
D. 实验③中,达到平衡时,a>0.10
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com