
(9分)工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化(生产中保持恒温恒容条件):2SO2(g)+O2(g)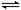 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
(1)生产中为提高反应速率和SO2的转化率,下列措施可行的是 。
A.向装置中充入O2 B.升高温度
C.向装置中充入N2 D.向装置中充入过量的SO2
(2)恒温恒压,通入3mol SO2和2mol O2 及固体催化剂,平衡时容器内气体体积为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为 5mol SO2(g)、3.5 mol O2(g)、1mol SO3(g),下列说法正确的是
A.第一次平衡时反应放出的热量为294.9kJ
B.两次平衡SO2的转化率相等
C.两次平衡时的O2体积分数相等
D.第二次平衡时SO3的体积分数等于2/9
(3)500 ℃时将10 mol SO2和5.0 mol O2置于体积为1L的恒容密闭容器中,SO2转化为SO3的平衡转化率为0.95。则500℃时的平衡常数K= 。
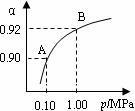
(4)550 ℃,A、B表示不同压强下的平衡转化率(如图),通常工业生产中采用常压的原因是 ,
并比较不同压强下的平衡常数:K(0.10 MPa) K(1.0 MPa)。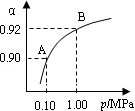
(1)A(2分) (2)CD(2分) (3)1.444x103(2分) 常压下400~500°C,SO2转化率已经很高了,加压必须增大投资以解决增加设备和提供能量问题(2分) =(1分)
解析试题分析:(1)充入氧气,则增大氧气的浓度,所以既能增大反应速率,也能提高SO2的转化率,A正确;正反应是放热反应,升高温度平衡向逆反应方向移动,转化率降低,B不正确;向装置中充入N2,压强增大,但浓度不变,平衡不移动,C不正确;向装置中充入过量的SO2,反应速率增大,但SO2的转化率降低,D不正确,答案选A。
(2)设第一次平衡时生成SO3是x,则消耗SO2和氧气的物质的量分别是x和0.5x,因此剩余SO2和氧气的物质的量分别是(3mol-x)、(2mol-0.5x)。所以有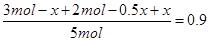 ,解得x=1mol。因此放出的热量是196.6 kJ·mol-1×0.5mol=98.3kJ,A不正确;SO3的体积分数是
,解得x=1mol。因此放出的热量是196.6 kJ·mol-1×0.5mol=98.3kJ,A不正确;SO3的体积分数是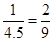 。根据方程式可知,5mol SO2(g)、3.5 mol O2(g)、1mol SO3(g)相当于是6mol SO2(g)、4 mol O2(g)。由于是保持恒温恒压的,因此平衡是等效的,所以平衡时SO3的物质的量是2mol,即反应中消耗1molSO2,因此选项B不正确,C和D都是正确的,答案选CD。
。根据方程式可知,5mol SO2(g)、3.5 mol O2(g)、1mol SO3(g)相当于是6mol SO2(g)、4 mol O2(g)。由于是保持恒温恒压的,因此平衡是等效的,所以平衡时SO3的物质的量是2mol,即反应中消耗1molSO2,因此选项B不正确,C和D都是正确的,答案选CD。
(3) 2SO2(g)+O2(g)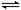 2SO3(g)
2SO3(g)
起始浓度(mol/L) 10 5 0
转化浓度(mol/L) 9.5 4.75 9.5
平衡浓度(mol/L) 0.5 0.25 9.5
所以该稳定性平衡常数K=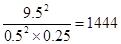
(4)根据图像可知,由于常压下400~500°C,SO2转化率已经很高了,加压转化率提高的幅度不大,但加压必须增大投资以解决增加设备和提供能量问题,显然是互经济的。平衡常数只与温度有关系,所以改变压强,平衡常数是不变的。
考点:考查外界条件对平衡状态的影响、可逆反应的有关计算、平衡常数的有关计算和判断等
点评:该题的难点在于等效平衡的判断上。所谓等效平衡是指外界条件相同时,同一可逆反应只要起始浓度相当,无论经过何种途径,都可以达到相同的平衡状态。等效平衡的判断及处理一般步骤是:进行等效转化——边倒法,即按照反应方程式的计量数之比转化到同一边的量,与题干所给起始投料情况比较。等效平衡一般有三种类型:I类:恒温恒容下对于反应前后气体体积发生变化的反应来说(即△n≠0的体系):等效转化后,对应各物质起始投料的物质的量与原平衡起始态相同。II类:恒温恒容下对于反应前后气体体积没有变化的反应来说(即△n=0的体系):等效转化后,只要反应物(或生成物)的物质的量的比例与原平衡起始态相同,两平衡等效。III类:恒温恒压下对于气体体系等效转化后,要反应物(或生成物)的物质的量的比例与原平衡起始态相同,两平衡等效。解答该类型试题的关键是分清类别,用相应的方法求解即可。


科目:高中化学 来源:2014届四川省高二“零诊”考试化学试卷(解析版) 题型:填空题
(9分)工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化(生产中保持恒温恒容条件):2SO2(g)+O2(g)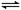 2SO3(g)
△H=-196.6 kJ·mol-1
2SO3(g)
△H=-196.6 kJ·mol-1
(1)生产中为提高反应速率和SO2的转化率,下列措施可行的是 。
A.向装置中充入O2 B.升高温度
C.向装置中充入N2 D.向装置中充入过量的SO2
(2)恒温恒压,通入3mol SO2 和2mol O2 及固体催化剂,平衡时容器内气体体积为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为 5mol SO2(g)、3.5 mol O2(g)、1mol SO3(g),下列说法正确的是
A.第一次平衡时反应放出的热量为294.9kJ
B.两次平衡SO2的转化率相等
C.两次平衡时的O2体积分数相等
D.第二次平衡时SO3的体积分数等于2/9
(3)500 ℃时将10 mol SO2和5.0 mol O2置于体积为1L的恒容密闭容器中,SO2转化为SO3的平衡转化率为0.95。则500℃时的平衡常数K= 。
(4)550 ℃,A、B表示不同压强下的平衡转化率(如图),通常工业生产中采用常压的原因是 ,
并比较不同压强下的平衡常数:K(0.10 MPa) K(1.0 MPa)。
查看答案和解析>>
科目:高中化学 来源:浙江省模拟题 题型:填空题
 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1 2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。
2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。 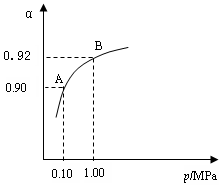
查看答案和解析>>
科目:高中化学 来源: 题型:
(9分)
工业上以黄铁矿(主要成分FeS2)为原料生产硫酸,其中重要的一步是催化氧化:
![]()
![]()
(1)生产中为提高反应速率和SO2的转化率,可采取的措施是 (填字母)。
A.向装置中充入N2 B.向装置中充入过量的Q2
C.使用高效催化剂 D.降低反应的温度
(2)在一密闭容器中充入amolSO2和一定量O2,当放出393.2kJ热量时,a的数值为 。
A. 4 B.<4 C.>4 D.无法判断
(3)判断在固定容积的密闭容器中![]() 达到平衡的标志是 。
达到平衡的标志是 。
①气体的密度不再变化 ②SO3的浓度不再变化
③气体的压强不再变化 ④反应混合物的物质的量不再变化
⑤SO2的转化率不再变化 ⑥气体的温度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上以黄铁矿为原料生产硫酸,其中重要的一步是催化氧化(生产中保持恒温恒容条件):2SO2(g)+O2(g)![]() 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
(1)生产中为提高反应速率和SO2的转化率,下列措施可行的是 。
A.向装置中充入O2 B.升高温度
C.向装置中充入N2 D.向装置中充入过量的SO2
(2)恒温恒压,通入3mol SO2 和2mol O2 及固体催化剂,平衡时容器内气体体积为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为 5mol SO2(g)、3.5 mol O2(g)、1mol SO3(g),下列说法正确的是
 A.第一次平衡时反应放出的热量为294.9kJ
A.第一次平衡时反应放出的热量为294.9kJ
B.两次平衡SO2的转化率相等 C.两次平衡时的O2体积分数相等
D.第二次平衡时SO3的体积分数等于2/9
(3)500 ℃时将10 mol SO2和5.0 mol O2置于体积为1L的恒容密闭容器中,SO2转化为SO3的平衡转化率为0.95。则500℃时的平衡常数K= 。
(4)550 ℃,A、B表示不同压强下的平衡转化率(如图),
通常工业生产中采用常压的原因是 ,
并比较不同压强下的平衡常数:K(0.10 MPa) K(1.0 MPa)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com