
| A. | HBr、HCl、HF | B. | BaSO4、NH4Cl、CH3COONa | ||
| C. | NaOH、Ca(OH)2、NH3•H2O | D. | HClO、CaCl2、SO2 |
分析 电解质是指:在水溶液或熔融状态下都能导电的化合物.能导电是电解质自身能电离出自由移动的离子;单质、混合物既不是电解质也不是非电解质.强电解质是指在水溶液中,或熔融状态下能完全电离的化合物,据此即可解答.
解答 解:A.HF是化合物,在水溶液中是部分电离的电解质,属于弱电解质,故A错误;
B.BaSO4、NH4Cl和CH3COONa都是盐,溶于水或熔融状态下能完全电离,均属于强电解质,故B正确;
C.一水合氨属于弱碱,是电解质,且为弱电解质,故C错误;
D.二氧化硫,SO2只存在分子,没有自由移动的离子,所以不能导电;二氧化硫在水溶液中与水反应生成亚硫酸,亚硫酸电离出自由移动的氢离子和亚硫酸根离子导电,二氧化硫自身不能电离,二氧化硫是非电解质,故D错误;
故选B.
点评 本题考查了强电解质的判断,抓住强电解质是在水溶液中或熔融状态下,能完全电离是解答本题的关键,题目难度不大,平时学习注意概念的辨析、基础知识的积累.


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:解答题
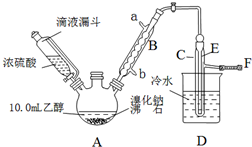
| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红色液体 |
| 密度/(g•cm-3) | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | X、Y的最高价氧化物的水化物之间不能反应 | |
| B. | 简单离子半径的大小顺序:rX>rY>rW>rQ | |
| C. | 工业上常用电解的方法制备X、Y的单质 | |
| D. | 元素Q和Z能形成QZ2型的共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分离苯和己烷--分液 | |
| B. | NO(NO2)--通过水洗、干燥后,用向下排气法收集 | |
| C. | 乙烷(乙烯)--让气体通过盛酸性高锰酸钾溶液的洗气瓶 | |
| D. | 乙醇(乙酸)--加足量NaOH溶液,蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化钠的水解反应:S2-+H3O+?HS-+H2O | |
| B. | 以石墨作电极电解氯化铝溶液:2C1-+2H2O $\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+C12↑ | |
| C. | 向沸水中滴加FeCl3溶液并加热制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3↓+3H+ | |
| D. | 向Ca(HCO3)2溶液中加入足量的NaOH溶液:Ca2++2HCO3-+2OH-=2H2O+CaCO3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 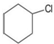 | B. | 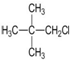 | C. | 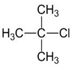 | D. | 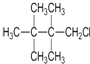 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+具有氧化性,Fe2+具有还原性 | |
| B. | Fe3+的水溶液呈红褐色,Fe2+的水溶液呈浅绿色 | |
| C. | Fe2+的溶液中滴入强碱溶液,立即出现红褐色沉淀 | |
| D. | 铁可以在氧气中燃烧生成Fe2O3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com