
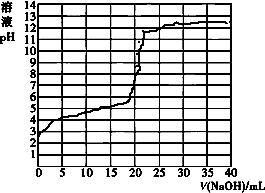
 酸碱中和滴定常用于测定酸碱溶液的浓度.
酸碱中和滴定常用于测定酸碱溶液的浓度.| V/(NaOH)/mL | 0.00 | 10.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 | 40.00 |
| 溶液pH | 2.87 | 4.74 | 5.70 | 6.74 | 7.74 | 8.72 | 9.70 | 10.70 | 11.70 | 12.50 |
 ;,
;, ;
;

 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案科目:高中化学 来源: 题型:
| 1NaNO2 |
| 2维生素C |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜与硫酸亚铁反应 Cu+Fe2+═Cu2++Fe |
| B、澄清的石灰水跟盐酸反应 H++OH-═H2O |
| C、碳酸钡溶于醋酸BaCO3+2H+═Ba2++H2O+CO2↑ |
| D、金属钠跟水反应Na+H2O═Na++OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某课外兴趣小组预测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组预测定某NaOH溶液的浓度,其操作步骤如下:| 滴定次数 | 标准盐酸体积/mL | 待测液体积/mL | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00 | 0.52 | 19.42 |
| 第二次 | 20.00 | 4.07 | 23.17 |
| 第三次 | 20.00 | 1.08 | 20.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:
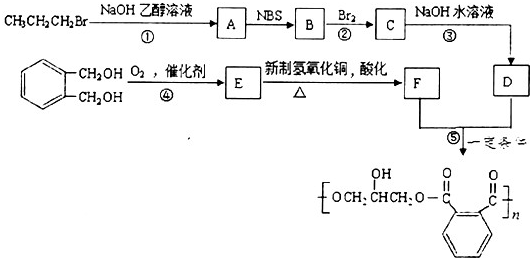
| NBS |
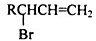
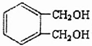 的同分异构体中同时符合下列条件的芳香族化合物共有
的同分异构体中同时符合下列条件的芳香族化合物共有查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、进行中和滴定时,直接向刚洗净的锥形瓶中加待测液 |
| B、滴定未知浓度的盐酸所用的0.5mol?L-1 NaOH溶液时,用甲基橙为指示剂,在配制标准溶液时因与空气接触吸收了少量的CO2 |
| C、用标准NaOH溶液滴定未知浓度的稀H2SO4时,用酚酞作指示剂 |
| D、往用蒸馏水洗净的滴定管中直接加入待测液,再注入锥形瓶中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com