
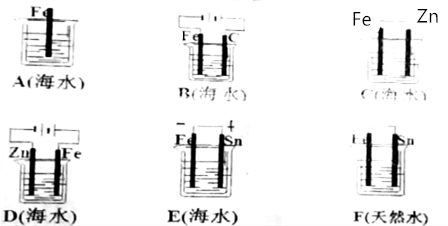
分析 作原电池负极和电解池阳极的金属易被腐蚀,作原电池正极或电解池阴极的金属易被保护,金属腐蚀快慢顺序是:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀,电解原理防护比原电池原理防护效果更好.
解答 解:A发生化学腐蚀;
B构成电解池,Fe作阴极,为外界电流的阴极保护法,Fe被保护;
C构成原电池,Zn为负极,Fe为正极,为牺牲阳极的阴极保护法,Fe被保护;
D构成电解池,Fe为阳极,Zn为阴极,Fe被腐蚀;
E、F均构成原电池,Fe比Sn活泼,Fe为负极,Fe比腐蚀,海水中电解质离子浓度大,腐蚀更严重,
电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀,电解原理防护比原电池原理防护效果更好,故铁的腐蚀由快到慢顺序:D>E>F>A>C>B,
故答案为:D>E>F>A>C>B.
点评 本题考查了金属的腐蚀与防护,明确原电池和电解池原理是解本题关键,注意电解质溶液导电性对金属腐蚀影响,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 常温下不能用铝制容器贮存 | |
| B. | 露置在空气中,容器内酸液的质量都增加 | |
| C. | 常温下都能与铜剧烈反应 | |
| D. | 露置在空气中,容器内酸液的浓度都减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaHSO4溶液中滴加Ba(OH)2溶液至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| B. | 向饱和Na2CO3溶液中通入足量CO2:2Na++CO32-+CO2+H2O=2NaHCO3↓ | |
| C. | 向Ca(HCO3)2溶液中加入足量Ca(OH)2溶液:Ca2++HCO3-+2OH-=CaCO3↓+CO32-+2H2O | |
| D. | 硫酸溶液于氢氧化钡溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 步骤 | 操作 | 现象 |
| (1) | 用pH试纸检验 | 溶液的pH大于7 |
| (2) | 另取少量溶液滴加过量氨水,再通入CCl4振荡,静置 | 上层无色,下层呈橙红色 |
| (3) | 取(2)的上层溶液,加入过量Ba(SO4)2溶液和稀硝酸,过滤 | 有白色沉淀产生 |
| (4) | 向(3)的滤液中加入过量AgNO3溶液和稀硝酸 | 有白色沉淀产生 |
| A. | 肯定含有的离子是Na+、Br-、SO32- | B. | 肯定没有的离子是Ba2+、SO42- | ||
| C. | 不能确定的离子是Na+ | D. | 不能确定的离子是Cl-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
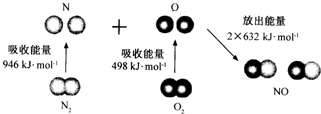
| A. | N2 (g)和O2(g)反应生成NO(g)是放热反应 | |
| B. | 2 molO原子结合生成O2(g)时需要吸收498kJ能量 | |
| C. | N2(g)+O2(g)=2NO(g)的反应热△H=+1444kJ•mol-1 | |
| D. | 1molNO(g)分子中的化学键断裂时需要吸收632kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al--Al2O3--Al(OH)3--NaAlO2 | B. | Fe--FeO--Fe(OH)2--Fe(OH)3 | ||
| C. | S--SO3--H2SO4--MgSO4 | D. | Na--Na2O2--Na2CO3--NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com