
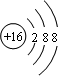
 ;主族元素原子电子层数与其周期数相等、最外层电子数与其族序数相等,N原子核外有2个电子层、最外层有5个电子,则N元素位于第二周期第VA族,
;主族元素原子电子层数与其周期数相等、最外层电子数与其族序数相等,N原子核外有2个电子层、最外层有5个电子,则N元素位于第二周期第VA族, ;第二周期第VA族;
;第二周期第VA族;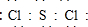 ,故答案为:
,故答案为: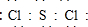 ;
;

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
| 浓硫酸 |
| 密度(g/mL) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 冰醋酸 | 1.049 | 16.6 | 118.1 | 能溶于水 |
| 异戊醇 | 0.812 | -117.2 | 130.5 | 微溶于水 |
| 乙酸异戊酯 | 0.869 | -78 | 140 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
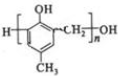 ,化合物C和化合物N的合成路线如下
,化合物C和化合物N的合成路线如下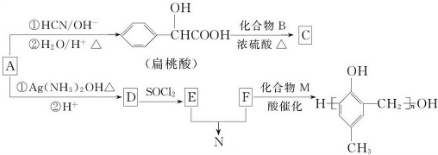
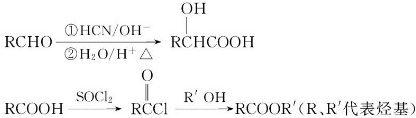
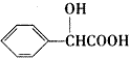 )有多种同分异构体.其中含有三个取代基,能与FeCl3溶液发生显色反应,也能与NaHCO3溶液反应放出气体的同分异构体共有
)有多种同分异构体.其中含有三个取代基,能与FeCl3溶液发生显色反应,也能与NaHCO3溶液反应放出气体的同分异构体共有查看答案和解析>>
科目:高中化学 来源: 题型:
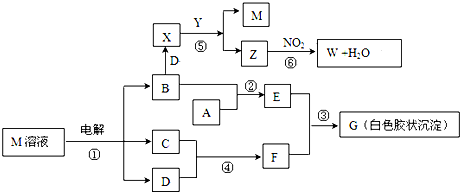
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、① | B、④ | C、①④⑤ | D、④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大于7 | B、小于7 |
| C、等于7 | D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳粉和氧气反应 |
| B、细铁丝在氧气中燃烧 |
| C、二氧化碳通入氢氧化钠溶液中 |
| D、铜和硝酸反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com