
美国科学家理查德·海克和日本科学家根岸英一、铃木彰因在研发“有机合成中的钯催化的交叉偶联”而获得2010年度诺贝尔化学奖。有机合成常用的钯/活性炭催化剂,长期使用催化剂会被杂质(如:铁、有机物等)污染而失去活性,成为废催化剂,需对其再生回收。一种由废催化剂制取氯化钯的工艺流程如下:
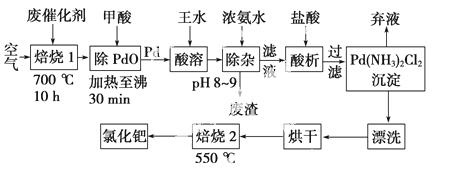
(1)废钯催化剂经烘干后,再在700 ℃的高温下焙烧,焙烧过程中需通入足量空气的原因是________________________________________________________________________;
甲酸还原氧化钯的化学方程式为____________________ ______________________。
______________________。
(2)钯在王水(浓硝酸与浓盐酸按体积比1∶3)中转化为H2PdCl4,硝酸还原为NO,该反应的化学方程式为______________________。
(3)钯精渣中钯的回收率高低主要取决于王水溶解的操作条件,已知反应温度、反应时间和王水用量对钯回收率的影响如下图1~图3所示,则王水溶解钯精渣的适宜条件(温度、时间和王水用量)为__________、__________、__________。

(4)加浓氨水时,钯转变为可溶性[Pd(NH3)2]2+,此时铁的存在形式是________________________________________________________________________(写化学式)。
(5)700 ℃焙烧1的目的是________________;550 ℃焙烧2的目的是________________。
科目:高中化学 来源: 题型:
下列有关化学用语表示正确的是 ( )
A.丙烯的结构简式:C3H6
B.氢氧根离子的电子式:
C.氯原子的结构示意图: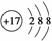
D.中子数为146、质子数为92的铀(U)原子: U
U
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.合成氨的“造气”阶段会产生废气
B.电镀的酸性废液用碱中和后就可以排放
C.电解制铝的过程中,作为阳极材料的无烟煤不会消耗
D.使用煤炭转化的管道煤气比直接燃煤可减少环境污染
查看答案和解析>>
科目:高中化学 来源: 题型:
钢铁工业对促进经济和社会发展起了重要作用。
(1)炼铁高炉分为五部分,铁矿石与高温煤气主要在________部分发生反应,在________部分开始生成生铁和炉渣。
(2)炼钢时,除磷的化学方程式为:_____________;
加入硅、锰和铝的目的是____________。
(3)不锈钢含有的 Cr 元素是在炼钢过程的氧吹________(填“前”或“后”)加入,原因是_________________。
(4)炼铁和炼钢生产中,尾气均含有的主要污染物是________。从环保和经济角度考虑,上述尾气经处理可用作_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
将海水淡化与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品。
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是 (填序号)。
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾、溴、镁的提取工艺
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收。碱吸收溴的主要反应是Br2+Na2CO3+H2O 
 NaBr + N
NaBr + N aBrO3+NaHCO3,吸收1mol Br2时,转移的电子数为 mol。
aBrO3+NaHCO3,吸收1mol Br2时,转移的电子数为 mol。
(3)海水提镁的一段工艺流程如下图:
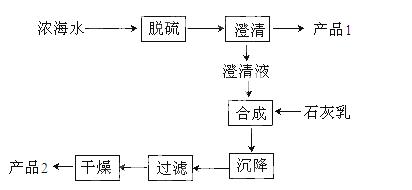
浓海水的主要成分如下:
| 离子 | N | Mg2+ | Cl- | SO42- |
| 浓度/g/L | 63.7 | 28.8 | 144.6 | 46.4 |
该工艺过程中,脱硫阶段主要反应的离子方程式为 ,产品2的化学式为 ,1L浓海水最多可得到产 品2的质量为 g。
品2的质量为 g。
(4)采用石墨阳极、不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为 ;电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某工厂用软锰矿(含MnO2约70%及Al2O3)和闪锌矿(含ZnS约80%及FeS)共同生产MnO2和Zn(干电池原料)。
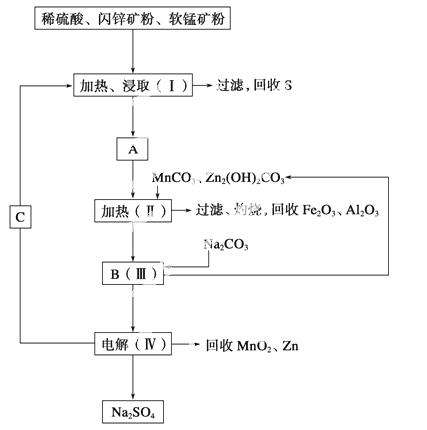
已知:①A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液。
②Ⅳ中电解方程式为MnSO4+ZnSO4+2H2O MnO2+Zn+2H2SO4。
MnO2+Zn+2H2SO4。
(1)A中属于还原产物的是______ ____。
____。
(2)加入MnCO3、Zn2(OH)2CO3的作用是_____________________________________
________________________________________________________________________。
Ⅱ需要加热的原因是____________________________________________________。
C的化学式是________________________。
(3)该生产中除得到MnO2和Zn以外,还可得到的副产品是________。
(4)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是________。
(5)要从Na2SO4溶液中得到芒硝(Na2SO4·10H2O),需进行的操作有蒸发浓缩、________、过滤、洗涤、干燥等。
(6)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿的质量比大约是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
参考下表中物质的熔点,回答有关 问题:
问题:
| 物质 | NaF | NaCl | NaBr | NaI | NaCl | KCl | RbCl | CsCl |
| 熔点/℃ | 995 | 801 | 755 | 651 | 801 | 776 | 715 | 646 |
| 物质 | SiF4 | SiCl4 | SiBr4 | SiI4 | SiCl4 | GeCl4 | SnCl4 | PbCl4 |
| 熔点/℃ | -90.4 | -70.4 | 5.2 | 120 | -70.4 | -49.5 | -36.2 | -15 |
(1)钠的卤化物及碱金属的氯化物的熔点与卤素离子及碱金属离子的________有关,随着________的增大,熔点依次降低。
(2)硅的卤化物的熔点及硅、锗、锡、铅的氯化物的熔点与________有关,随着________增大,________增大,故熔点依次升高。
(3)钠的卤化物的熔点比相应的硅的卤化物的熔点高得多,这与________有关,因为_______________,
故前者的熔点远高于后者。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
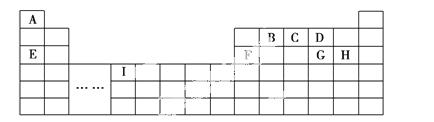
(1)写出由上述两种元素组成X2Y2型化合物的化学式分别为____________,其晶体类型分别为__________________。
(2)B、C、D的氢化物中,沸点最高的氢化物的结构式是____________,富含沸点最低的氢化物的矿物的名称是____________。
(3)上述元素形成的单质中,属于原子晶体的是________(填名称),其空间构型为________________。
(4)写出由上述元素中相同的四种元素组成的两种化合物的水溶液发生反应的离子方程式:_____________________。
(5)写出由上述元素中的三种形成的既含有离子键又含有极性共价键的化合物的电子式:____________________(任写两个)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在20℃时一钢性容器内部有一个不漏气且可滑动的活塞将容器分隔成左右两室。左室充入N2,右室充入H2和O2,活塞正好停留在离左端的1/4处(如图甲所示),然后点燃H2和O2,反应完毕 后恢复到原来温度,活塞恰好停在中间(如图乙所示),水蒸气的体积可忽略,则反应前H2和O2的体积比可能是( )
后恢复到原来温度,活塞恰好停在中间(如图乙所示),水蒸气的体积可忽略,则反应前H2和O2的体积比可能是( )


图甲 图乙
①3∶4 ②4∶5 ③6∶2 ④7∶2
A.①③ B.②④ C.①② D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com