
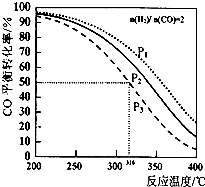
 以$\frac{n({H}_{2})}{n(CO)}$=2 通入IL的反应器中,一定条件T 发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O (g)△H,其中CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是( )
以$\frac{n({H}_{2})}{n(CO)}$=2 通入IL的反应器中,一定条件T 发生反应:4H2(g)+2CO(g)?CH3OCH3(g)+H2O (g)△H,其中CO的平衡转化率随温度、压强变化关系如图所示.下列说法正确的是( )| A. | 该反应的△H>O | |
| B. | P1<P2<P3 | |
| C. | 若在P3和316℃时反应达到平衡,H2的转化率等于50% | |
| D. | 若在P1和200℃时,反应达平衡后保持温度和压强不变,再充入2 mol H2和1molCO,则平衡时二甲醚的体积分数增大 |
分析 A.由图可知,压强一定时,温度越高,平衡时CO的转化率越低,说明升高温度平衡向逆反应方向移动;
B.正反应为气体体积减小的反应,温度一定时,增大压强平衡向正反应方向移动,CO的转化率增大;
C.在P3和316℃时反应达到平衡,CO的转化率为50%,结合开始时$\frac{n({H}_{2})}{n(CO)}$=2 计算;
D.若在P1和200℃时,反应达平衡后保持温度和压强不变,再充入2 mol H2和1molCO,与起始比值相同,为等效平衡.
解答 解:A.由图可知,压强一定时,温度越高,平衡时CO的转化率越低,说明升高温度平衡向逆反应方向移动,故正反应为放热反应,即△H<0,故A错误;
B.由图可知转化率P1>P2>P3,正反应为气体体积减小的反应,温度一定时,增大压强平衡向正反应方向移动,CO的转化率增大,故压强P1>P2>P3,故B错误;
C.以n(H2):n(CO)=2通入1L的反应器中,令n(H2)=2mol、n(CO)=1mol,在P3和316℃时反应达到平衡,CO的平衡转化率为50%,即转化0.5mol,
4H2(g)+2CO(g)?CH3OCH3(g)+H2O
起始(mol) 2 1
转化(mol) 1 0.5
则H2的转化率$\frac{1}{2}$×100%=50%,
故C正确;
D.若在P1和200℃时,反应达平衡后保持温度和压强不变,再充入2 mol H2和1molCO,与起始比值相同,为等效平衡,则体积分数不变,故D错误.
故选C.
点评 本题考查化学平衡图象、化学平衡影响因素及有关计算,为高频考点,侧重于学生的分析、计算能量的考查,难度中等,注意理解外界条件对平衡移动的影响,理解等效平衡的意义.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氮氧化铝中氮的化合价是-3 | |
| B. | 反应中氧化产物和还原产物的物质的量之比是1:2 | |
| C. | 反应中每生成5.7gAlON同时生成1.12LCO | |
| D. | AlON和CO的化学键类型不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
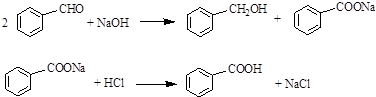
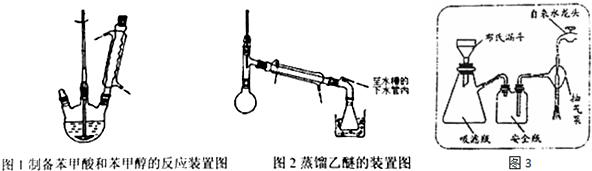
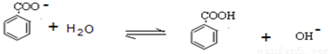 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
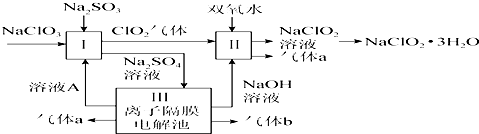
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
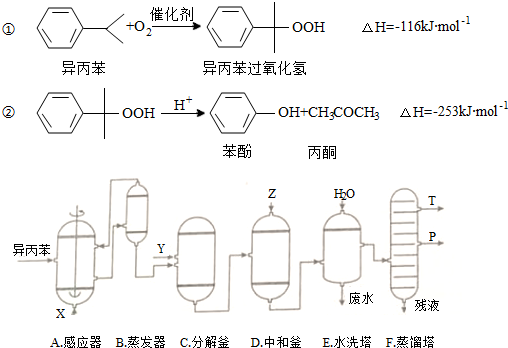
| 物质 | 相对分子质量 | 密度(g/cm-3) | 沸点/℃ |
| 异丙苯 | 120 | 0.8640 | 153 |
| 丙酮 | 58 | 0.7898 | 56.5 |
| 苯酚 | 94 | 1.0722 | 182 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
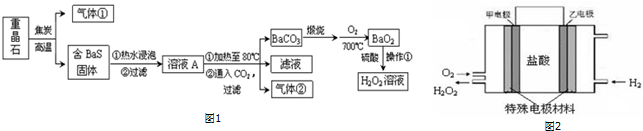
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成 分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | 其他不溶于酸的物质 |
| 质量分数/% | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 |
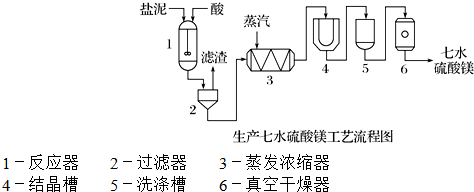
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备Fe(OH)3胶体:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| B. | H2SO4溶液中投入锌粒:2H++Zn═H2↑+Zn2+ | |
| C. | 用NaHCO3 治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| D. | 氯化铁和氢氧化钾溶液混合:Fe3++3OH-═Fe(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com