
在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断
正确的是( )
A.在含等物质的量的AlO2-、OH-、CO32--的溶液中,逐滴加入盐酸:AlO2-、OH-、CO32-
B.在含等物质的量的FeBr2、Fel2的溶液中,缓慢通入氯气:I-、Br-、Fe2+
C.在含等物质的量的Ba(OH)2、KOH的溶液中,缓慢通入CO2: KOH、Ba(OH)2、K2CO3、BaCO3
D.在含等物质的量的Fe3+、Cu2+、H+的溶液中加入锌粉:Fe3+、Cu2+、H+、Fe2+
【知识点】离子反应 B1 B3
【答案解析】D 解析:A、若H+最先与AlO2-反应,生成氢氧化铝,而氢氧化铝与溶液中OH-反应生成AlO2-,反应顺序为OH-、AlO2-、CO32-,故A错误;
B、离子还原性I->Fe2+>Br-,氯气先与还原性强的反应,氯气的氧化顺序是I-、Fe2+、Br-,因为2Fe2++Br2=2Fe3++2Br-,故B错误;
C、氢氧化钡先发生反应,因为碳酸钾与氢氧化钡不能共存,故C错误;
D、氧化性顺序:Fe3+>Cu2+>H+>Fe2+,锌粉先与氧化性强的反应,反应顺序为Fe3+、Cu2+、H+、Fe2+,故D正确.故答案选D
【思路点拨】本题考查了离子反应的先后顺序等,难度较大,清楚反应发生的本质与物质性质是关键,注意元素化合物知识的掌握。


科目:高中化学 来源: 题型:
A、B、C三种强电解质,它们在水中电离出的离子如下表所示:
| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极。
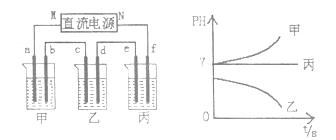
接通电源,经过一端时间后,测得乙中c电极质量增加了27克。常温下各烧杯中溶液的pH与电解时间t的关系图如上。据此回答下列问题:
(1)M为电源的 极(填写“正”或“负”),甲、乙电解质分别为 、 (填写化学式)。
(2)要使电解后丙中溶液恢复到原来的状态,应加入 物质。(填写化学式)
(3) 若电解后甲溶液的体积为25L,且产生的气体全部逸出。该溶液常温时的pH为 。
(4)写出乙烧杯中发生反应的离子方程式
(5)写出甲烧杯中发生反应的离子方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式是
A.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O
B.Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+4H2O
C.磁性氧化铁溶于稀硝酸:Fe3O4+8H+=Fe2++2Fe3++4H2O
D.明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:
2Ba2++3OH-+Al3++2SO42-=2BaSO4↓+Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
某强酸性溶液X中仅含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:
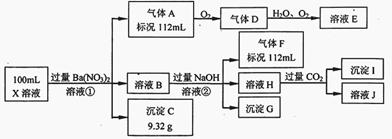
根据以上信息,回答下列问题:
(1)仅根据上述连续实验不能确定溶液X中是否含有的阳、阴离子分别是_____________。
若要用实验证明该阴离子是否存在,最可靠的化学方法是_____________。
(2)尽量用离子方程表达下列反应:
①中生成气体A:_____________。
②中生成溶液H:_____________。
③中产生的气体F遇氯气产生白烟:_____________。
(3)若②中所用氢氧化钠浓度为2mol/L,当加入l0 ml时开始产生沉淀,55 ml时沉淀的量达到最大值0.03 mol,继续滴加沉淀的量保持不变,随后再滴加沉淀部分溶解,到60ml时沉淀的量降为0.025 mol且保持不变,则原溶液中c(Fe2+)为___________mol/L、c(Fe3+)为___________mol/L、c(Cl-)为___________mol/L。(若有些离子不存在,请填0 mol/L)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在指定溶液中能大量共存的是
A.常温下,c(H+)/c(OH-)=1×10-12的溶液:K+、AlO2-、CO32-、Na+
B.某溶液中可能大量存在:Fe3+、K+、HCO3-、SO42-
C.使pH试纸变蓝的溶液中:NH4+、Na+、SO42-、Cl-
D.酸性溶液中:K+、Al3+、I-、ClO-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于物质的检验方法正确的是( )
A.向某无色溶液中滴加氯化钡溶液,产生白色沉淀,再加入稀盐酸后该沉淀不溶解,说明原溶液中一定含有SO42-离子
B.向某混有KI杂质的溶液中加入足量FeCl3溶液,用CCl4萃取,在无色的水层中加入氯水,溶液呈橙黄色,则该溶液中含有Br-
C.向某白色固体粉末中滴加稀盐酸,产生使澄清石灰水变浑浊的气体,则原固体粉末中一定含有CO32-或者HCO3-离子
D.某溶液能使淀粉碘化钾溶液变蓝,则该溶液一定为氯水或者溴水
查看答案和解析>>
科目:高中化学 来源: 题型:
钾水玻璃以其优异的性能广泛用于防腐、铸造、油田、钻井或各种高档涂料中。钾水玻璃中硅含量的测定可以采用氟硅酸钾容量法,其步骤为:
①称取试样溶解在含有过量的氟离子和钾离子的强酸溶液中,硅能与氟离子、钾离子作用生成氟硅酸钾(K2SiF6)沉淀;
②沉淀分离后于热水中水解,生成HF、H2SiO3、KF;
③过滤除去硅酸沉淀,用氢氧化钠标准溶液滴定滤液。
(1)上述步骤②中的水解反应方程式为 ;
步骤③中反应的离子方程式为: 。
(2)在步骤③中,若滴定前未用氢氧化钠标准溶液润洗滴定管,则测得的硅元素含量将
(填“偏高”、或“偏低”或“不变”)。
(3)若每次称取试样的质量为1.00g,重复滴定四次,消耗1.00 mol·L-1氢氧化钠标准溶液的体积为分别为16.80mL、19.90mL、20.00mL、20.10mL,试计算该试样中硅元素的质量分数(以二氧化硅计),写出计算过程。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学家们合成了如图所示的一系列星烷,如三星烷、四星烷、五星烷等。下列说法正确的是( )
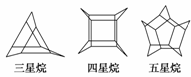
A.它们之间互为同系物
B.六星烷的化学式为C18H24
C.四星烷与互 为同分异构体
为同分异构体
D.它们的一氯代物均只有两种,而三星烷的二氯代物有四种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com