
 某研究性小组为探究铜跟浓
某研究性小组为探究铜跟浓
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:阅读理解


| 猜想 | 验证方法 | 预测现象及结论 |
| 认为铜片中可能含有锌等杂质 |
| 猜想 | 预计验证方法 | 猜想的现象与结论 |
| 白色沉淀是氯化亚铜 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2010?祁阳县一模)某校化学研究性学习小组为探究铜及其化合物的性质,进行了如下科学探究:
(2010?祁阳县一模)某校化学研究性学习小组为探究铜及其化合物的性质,进行了如下科学探究:| 物质 | 性质 | 物质 | 性质 |
| 氯化铜 | 浓溶液呈绿色,稀溶液呈蓝色 | 氯化亚铜 | 白色 |
| 氧化亚铜 | 砖红色,在酸性条件下易反应: Cu2O+2H+=Cu+Cu2++H2O. Cu2O在空气中灼烧生成CuO |
氢氧化亚铜 | 橙黄色,不稳定 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:2010年安徽省高三教学质量检测试卷(三)理科综合化学 题型:填空题
(11分)某研究性学习小组为探究铜、锌与浓盐酸的反应,设计实验探究方案如下:
实验用品:纯锌片、铜片、37%的浓盐酸、蒸馏水、氯化钾溶液、稀硝酸溶液
实验记录:
背影资料:
|
|
| 猜想 | 验证方法 | 预测现象及结论 |
| 认为铜片中可能含有锌等杂质 | | |
| 猜想 | 预计验证方法 | 猜想的现象与结论 |
| 白色沉淀是氯化亚铜 | | |
| | |
查看答案和解析>>
科目:高中化学 来源: 题型:
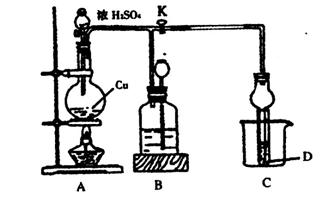
请回答:
(1)装置A中发生反应的化学方程式为_______________________________。
(2)装置C中试管D内盛装的是品红溶液,当打开旋塞K后,D中的现象是_______________;待反应结束后关闭旋塞K,往烧杯中加入沸水,E中的现象是_________________;实验时装置C有可能造成环境污染,试用最简单的方法加以解决(实验用品自选)_________________。
(3)装置B的作用是贮存多余的气体,实验完后,移去酒精灯,但由于余热的作用A处仍有气体产生。此时B中现象是_______________,B中应放置的液体是(填字母)______________。
A.浓溴水 B.水 C.氨水 D.饱和NaHSO3溶液
(4)实验时,该小组同学取一定质量的铜片和一定体积18 mol·L-1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,他们根据所学的化学知识判断还有一定量的硫酸剩余。请你解释有一定量的余酸但未能使铜片完全溶解的原因____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com