
【题目】下列对有机物结构或性质的描述中错误的是
A. 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应
B. 乙烷和丙烯的物质的量共1mol,完成燃烧生成3molH2O
C. 用核磁共振氢谱鉴别1—丙醇和2—丙醇
D. 间二溴苯仅有一种空间结构可证明苯分子中不存在单双键交替的结构
科目:高中化学 来源: 题型:
【题目】如图所示是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( ) 
A.原子半径:Z>Y>X
B.气态氢化物的稳定性:R>W
C.WX3和水反应形成的化合物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物不能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类正确的是
A. NO2、Cl2O7都是酸性氧化物B. 水银、水玻璃都是混合物
C. HD、HCHO都是极性分子D. 干冰、可燃冰都是分子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a、b、c均为石墨电极,d为铁电极,通电进行电解。假设在电解过程中产生的气体全部逸出,下列说法正确的是( )

A.乙烧杯中的d电极反应式为Fe-2e-=Fe2+
B.电解一段时间后,将甲、乙两溶液混合,一定会产生沉淀
C.当b极增重5.4g时,d极产生的气体为2.24L(标况)
D.甲烧杯中溶液的pH降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料.
(1)在25℃、101kPa时,16gCH4完全燃烧生成液态水时放出的热量是890.31kJ,则CH4燃烧的热化学方程式为_____________,
(2)已知:C(s)+O2(g)═CO2(g);△H=﹣437.3 kJmol﹣1
H2(g)+O2(g)═H2O(g);△H=﹣285.8 kJmol﹣1
CO(g)+O2(g)═CO2(g);△H=﹣283.0 kJmol﹣1
则煤气化反应C(s)+H2O(g)═CO(g)+H2(g) 的焓变△H=__________kJmol﹣1;
(3)如图所示组成闭合回路,其中,甲装置中CH4为负极,O2和CO2的混合气体为正极,稀土金属材料为电极,以熔融碳酸盐为电解质;乙装置中a、b为石墨,b极上有红色物质析出,CuSO4溶液的体积为200mL.

①装置中气体A为___________(填“CH4”或“O2和CO2”),d极上的电极反应式为___________;
②乙装置中a极上的电极反应式为_________.若在a极产生112mL(标准状况)气体,则甲装置中消耗CH4______mL(标准状况),乙装置中所得溶液的pH=_________.(忽略电解前后溶液体秋变化)
③如果乙中电极不变,将溶液换成饱和Na2SO3溶液,当阴极上有a mol气体生成时,同时有w g Na2SO410H2O晶体析出,若温度不变,剩余溶液中溶质的质量分数应为______________(用含w、a的表达式表示,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.C2H6和C3H8均不存在同分异构现象B.金刚石和足球烯互为同素异形体
C.C2H4和C3H6互为同系物D.乙醇和甲醚互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列叙述错误的是( )
A. 硅胶、铁粉均可作为食品包装中的抗氧化剂
B. 福尔马林能防腐,但不能用于食品保鲜
C. 可溶性的铝盐和铁盐可用作净水剂
D. 人工合成的硅橡胶是既耐高温又耐低温的橡胶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用软锰矿(主要成分是MnO2,含少量Al2O3和SiO2)和闪锌矿(主要成分是ZnS,含少量FeS、CuS等杂质)为原料制备MnO2和Zn(干电池原料),其简化流程如下:
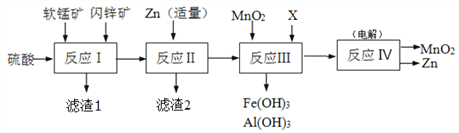
已知:反应Ⅰ中所有金属元素均以离子形式存在。
回答下列问题:
(1)滤渣1中除了SiO2以外,还有一种淡黄色物质,该物质是由MnO2、CuS与硫酸共热时产生的,请写出该反应的离子方程式________________________________。
(2)反应Ⅱ中加入适量金属锌的目的是为了回收某种金属,滤渣2的主要成分是______(填名称)。
(3)反应Ⅲ中MnO2的作用是______,另外一种物质X可以是______。(填字母代号)
a.MgO b.Zn(OH)2 c.Cu2(OH)2CO3 d.MnCO3
(4)反应Ⅳ中电极均是惰性电极,写出阳极电极反应式_______________。本工艺可以循环利用的物质有MnO2、Zn和_____。
(5)已知:H2S的电离常数K1=1.0×107,K2=7.0×1015。0.1 mol/L NaHS的pH___7(填“>”“=”或“<”),理由是________________________________________。
(6)在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L1 Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS浓度为1.0×104 mol·L1时,Mn2+开始沉淀,则a=________。[已知:Ksp(MnS)=1.4×1015]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com