
| A. | 氧化剂本身被还原,生成氧化产物 | |
| B. | 氧化剂是在反应中得到电子(或电子对偏向)的物质 | |
| C. | 还原剂在反应时所含元素的化合价降低 | |
| D. | 在一个反应中,氧化剂和还原剂不可能是同一物质 |
分析 A.氧化剂在反应中得到电子被还原,发生还原反应;
B.氧化剂具有氧化性,在反应中得到电子(或电子对偏向);
C.还原剂在反应中失去电子被氧化,所含元素的化合价升高;
D.在同一个反应中,氧化剂和还原剂可以为同一种物质,如氯气与氢氧化钠溶液、过氧化钠与水、二氧化碳的反应.
解答 解:A.氧化剂在反应中得到电子,化合价降低被还原,得到的产物为还原产物,故A错误;
B.氧化剂在反应中化合价降低,是得到电子(或电子对偏向)的物质,故B正确;
C.还原剂在反应中失去电子,所含元素的化合价升高被氧化,故C错误;
D.氧化还原反应中,氧化剂和还原剂可以是同一种物质,如氯气与氢氧化钠溶液的反应中,氯气既是氧化剂也是还原剂,故D错误;
故选B.
点评 本题考查了氧化还原反应,题目难度不大,明确氧化剂、还原剂的概念为解答关键,注意掌握氧化还原反应的实质与特征,D为易错点,注意氧化剂和还原剂可以是同一种物质.


科目:高中化学 来源: 题型:选择题
| A. | 铝在空气中耐腐蚀,所以铝是不活泼金属 | |
| B. | 氧化铜和氧化亚铜都是黑色固体 | |
| C. | 铝在高温下能还原锰、铁、铬等金属氧化物得到金属 | |
| D. | 因为镁和铝在空气中都能形成氧化膜,所以镁铝都不能溶于浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
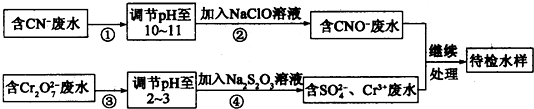
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量的铁粉投入一定量的热浓硫酸中,将产生的气体通人浓NaOH溶液中,气体可全部被吸收 | |
| B. | 25℃下,pH=0的溶液中,A13+、NH${\;}_{4}^{+}$、NO${\;}_{3}^{-}$、Fe2+可以大量共存 | |
| C. | 检验红砖中的氧化铁,向红砖粉末中加人盐酸,充分反应后取上层清液于试管中,滴加2~3滴KSCN溶液即可 | |
| D. | 向CuSO4溶液中滴人过量NaOH溶液充分反应后,将混合溶液倒人蒸发皿中加热煮沸一段时间,然后冷却、过滤、滤纸上的物体为“蓝色固体” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只含离子键的化合物称为离子化合物 | |
| B. | 化学键不仅存在于原子间,也存在于分子间 | |
| C. | 原子间通过极性键结合成分子的物质,一定是共价化合物 | |
| D. | 不同元素组成的多原子分子里的化学键一定是极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 建筑使用了大量钢材,钢材是纯铁 | |
| B. | 明矾与水反应生成氢氧化铝胶体能吸附水中悬浮物,可用于水的净化 | |
| C. | Al2O3的熔点很高,可用于制作耐高温材料 | |
| D. | 用焰色反应可鉴别K2CO3和NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
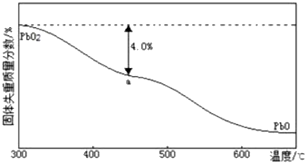
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com