
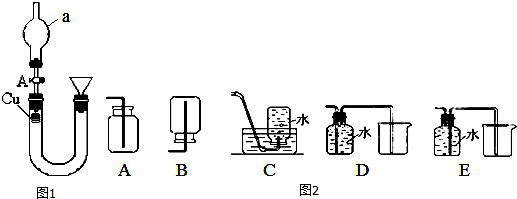
·ÖĪö £Ø1£©×°ÖĆÖŠaŅĒĘ÷µÄĆū³ĘĪŖŹĒĒņŠĪøÉŌļ¹Ü£»
£Ø2£©¼ÓČėĻõĖįµÄ²Ł×÷£ŗÓ¦ĻČ“ņæŖ»īČūA±£Ö¤UŠĪ¹ÜÄŚŃ¹ĒæĘ½ŗā£¬ĒŅÅųöĘųĢå£¬Č»ŗó“ÓÓŅ¹ÜµÄĀ©¶·ÖŠĻņUŠĪ¹ÜÖŠÖš½„×¢ČėĻ”ĻõĖį£®µ±×¢Āśŗó£¬Ó¦¹Ų±Õ»īČūA£¬ĶŗĶĻ”ĻõĖį·“Ӧɜ³ÉĻõĖįĶŗĶĪŽÉ«ĘųĢåŅ»Ńõ»ÆµŖ£¬ĻõĖįĶĪŖĄ¶É«£»“ż·“Ó¦Ņ»»įŗóČō“ņæŖ»īČūA£¬æÕĘų½ųČė£¬Ņ»Ńõ»ÆµŖ±»Ńõ»Æ³É¶žŃõ»ÆµŖ£»
£Ø3£©Ņ»Ńõ»ÆµŖÓŠ¶¾ĒŅŅ×ŗĶŃõĘų·“Ӧɜ³É¶žŃõ»ÆµŖ£¬Ņ»Ńõ»ÆµŖ²»ŗĶĖ®·“Ó¦£¬ĖłŅŌ²»ÄÜÓĆÅÅĖ®·ØŹÕ¼Æ£¬Ó¦øĆÓĆÅÅĖ®·ØŹÕ¼Æ£»
£Ø4£©øł¾Żn=$\frac{m}{M}$¼ĘĖć1.92gĶĪļÖŹµÄĮ棬ĶŠ¼Ķ¶ČėHNO3ŗĶH2SO4µÄ»ģŗĻČÜŅŗÖŠ·¢ÉśµÄ·“Ó¦£ŗ3Cu+8H++2NO3-=3Cu2++2NO+4H2O£¬½įŗĻĶ”¢ĻõĖįøł”¢ĒāĄė×ÓµÄĪļÖŹµÄĮæøł¾ŻĄė×Ó·½³ĢŹ½½ųŠŠ¹żĮæ¼ĘĖć£¬ŌŁøł¾Ż²»×ćµÄĪļÖŹ¼ĘĖćĶĄė×ÓµÄĪļÖŹµÄĮ棬½įŗĻc=$\frac{n}{V}$¼ĘĖćĶĄė×ÓÅØ¶Č£»
£Ø5£©ĻõĖį²»ĪČ¶Ø·Ö½ā²śÉśµÄ¶žŃõ»ÆµŖČܽāĘäÖŠ³Ź»ĘÉ«£®
½ā“š ½ā£ŗ£Ø1£©×°ÖĆÖŠaŅĒĘ÷ŗ¬ÓŠµäŠĶµÄĒņÅŻĢŲÕ÷£¬ĪŖĒņŠĪøÉŌļ¹Ü£¬
¹Ź“š°øĪŖ£ŗĒņŠĪøÉŌļ¹Ü£»
£Ø2£©¼ÓČėĻõĖįµÄ²Ł×÷£ŗÓ¦ĻČ“ņæŖ»īČūA±£Ö¤UŠĪ¹ÜÄŚŃ¹ĒæĘ½ŗā£¬Ķ¬Ź±°ŃUŠĪ¹Ü×ó²ąµÄæÕĘųÅųö£¬ĶĖæŗĶĻõĖį·“Ó¦£¬ĖłŅŌµ±×¢Āśŗó£¬Ó¦¹Ų±Õ»īČūA£¬ĶŗĶĻ”ĻõĖį·“Ӧɜ³ÉĻõĖįĶŗĶĪŽÉ«ĘųĢåŅ»Ńõ»ÆµŖ£¬ĻõĖįĶĪŖĄ¶É«£¬ĖłŅŌ“ĖŹ±¹Ū²ģµ½µÄĻÖĻóĪŖUŠĶ¹Ü×ó¹ÜÖŠ£¬Ķ±ķĆęÓŠĪŽÉ«ĘųĢåÉś³É£¬ŅŗĆęĻĀ½µ£¬ČÜŅŗÖš½„±äĪŖĄ¶É«£¬“ż·“Ó¦Ņ»»įŗóČō“ņæŖ»īČūA£¬æÕĘų½ųČė£¬ŌŚøÉŌļ¹ÜÖŠĪŽÉ«µÄŅ»Ńõ»ÆµŖ±»Ńõ»Æ³Éŗģ×ŲÉ«µÄ¶žŃõ»ÆµŖ£¬×ó¹ÜŅŗĆęÉĻÉż£¬
¹Ź“š°øĪŖ£ŗ“ņæŖ£»¹Ų±Õ£»UŠĶ¹Ü×ó¹ÜÖŠ£¬Ķ±ķĆęÓŠĪŽÉ«ĘųĢåÉś³É£¬ŅŗĆęĻĀ½µ£¬ČÜŅŗÖš½„±äĪŖĄ¶É«£»ŌŚøÉŌļ¹Ü֊擵½ĘųĢå±äĪŖŗģ×ŲÉ«£¬×ó¹ÜŅŗĆęÉĻÉż£»
£Ø3£©Ņ»Ńõ»ÆµŖÓŠ¶¾ĒŅŅ×ŗĶŃõĘų·“Ӧɜ³É¶žŃõ»ÆµŖ£¬Ņ»Ńõ»ÆµŖ²»ŗĶĖ®·“Ó¦£¬ĖłŅŌ²»ÄÜÓĆÅÅĖ®·ØŹÕ¼Æ£¬Ó¦øĆÓĆÅÅĖ®·ØŹÕ¼Æ£¬ÅÅĖ®×°ÖĆÖŠ£¬ĘųĢåµÄ½ų³öæŚ·ūŗĻ”°¶Ģ½ų³¤³ö”±µÄŌŌņ£¬¹ŹCE·ūŗĻ£¬
¹Ź“š°øĪŖ£ŗC”¢E£»
£Ø4£©ČÜŅŗÖŠµÄĒāĄė×Ó°üĄØĻõĖį”¢ĮņĖįµēĄėµÄ£¬ĖłŅŌn£ØH+£©=0.4mol/L”Į0.1L+0.1mol/L”Į0.1L”Į2=0.06mol£¬n£ØNO3-£©n=0.4mol/L”Į0.1L=0.04mol£¬1.92gĶµÄĪļÖŹµÄĮæĪŖ$\frac{1.92g}{64g/mol}$=0.03mol£¬Ōņ£ŗ
3Cu+8H++2NO3-=3Cu2++2NOӟ+4H2O
3 8 2
0.03mol 0.08mol 0.02mol
ĖłŅŌĒāĄė×ÓµÄĪļÖŹµÄĮæ²»×ć£¬øł¾ŻĒāĄė×ÓµÄĪļÖŹµÄĮæ¼ĘĖć£¬ÓÉĄė×Ó·½³ĢŹ½æÉÖŖ0.06molĒāĄė×Ó·“Ó¦£¬Éś³ÉµÄĶĄė×ÓµÄĪļÖŹµÄĮæĪŖ0.06mol”Į$\frac{3}{8}$=0.0225mol£¬ĖłŅŌČÜŅŗÖŠc£ØCu2+£©=$\frac{0.0225mol}{0.1L}$=0.225mol/L£¬
¹Ź“š°øĪŖ£ŗ0.225mol/L£»
£Ø5£©ÅØĻõĖį²»ĪČ¶Ø£¬ŹÜČČ»ņ¼ū¹ā·Ö½ā²śÉśµÄŗģ×ŲÉ«¶žŃõ»ÆµŖČܽāĘäÖŠ³Ź»ĘÉ«£¬·“Ó¦·½³ĢŹ½ĪŖ4HNO3£ØÅØ£©$\frac{\underline{\;¹āÕÕ\;}}{\;}$4NO2”ü+O2”ü+2H2O£¬
¹Ź“š°øĪŖ£ŗÅØĻõĖįŹÜČČ»ņ¼ū¹āŅ×·Ö½ā²śÉśŗģ×ŲÉ«µÄ¶žŃõ»ÆµŖĘųĢå£Ø4HNO3$\frac{\underline{\;¹āÕÕ\;}}{\;}$4NO2”ü+O2”ü+2H2O£©£¬øĆĘųĢåČÜÓŚÅØĻõĖįÖŠ£¬¶ųŹ¹ČÜŅŗ±äĪŖ»ĘÉ«£®
µćĘĄ ±¾Ģāæ¼²éĮĖĻõĖįµÄŠŌÖŹŹµŃéĢ½¾æ£¬²ąÖŲÓŚµŖŃõ»ÆĪļµÄŠŌÖŹµÄ漲飬ĪŖøßĘµæ¼µć£¬°ŃĪÕĪļÖŹµÄŠŌÖŹ¼°·¢ÉśµÄ·“Ó¦ĪŖ½ā“šµÄ¹Ų¼ü£¬²ąÖŲ·ÖĪöÓėÓ¦ÓĆÄÜĮ¦µÄ漲飬עŅāĻõĖįµÄŠŌÖŹ£¬ĢāÄæÄѶČÖŠµČ£®


 µ¼Ń§Óė²āŹŌĻµĮŠ“š°ø
µ¼Ń§Óė²āŹŌĻµĮŠ“š°ø ŠĀ·Ē·²½Ģøسå“Ģ100·ÖĻµĮŠ“š°ø
ŠĀ·Ē·²½Ģøسå“Ģ100·ÖĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | °±Ė® | B£® | NH4Cl | C£® | NaCl | D£® | HCl |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ±ąŗÅ ŌŖĖŲ ŠŌÖŹ | ¢Ł | ¢Ś | ¢Ū | ¢Ü | ¢Ż | ¢Ž | ¢ß | ¢ą |
| Ō×Ó°ė¾¶£Ø10-10m£© | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| ×īøß»ņ×īµĶ»ÆŗĻ¼Ū | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
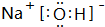 £» ŹōĄė×Ó»ÆŗĻĪļ£ØĢī”°Ąė×Ó”±»ņ”°¹²¼Ū”±£©£®
£» ŹōĄė×Ó»ÆŗĻĪļ£ØĢī”°Ąė×Ó”±»ņ”°¹²¼Ū”±£©£® ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | µē×ÓŹż | B£® | ×īĶā²ćµē×ÓŹż | C£® | µē×Ó²ćŹż | D£® | K²ćµē×ÓŹż |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
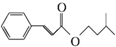 £©ŹĒŅ»ÖÖĻćĮĻ£¬Ņ»ÖÖŗĻ³ÉĀ·ĻßČēĶ¼£ŗ
£©ŹĒŅ»ÖÖĻćĮĻ£¬Ņ»ÖÖŗĻ³ÉĀ·ĻßČēĶ¼£ŗ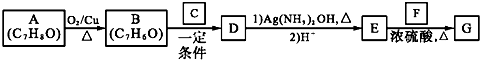
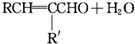
 +CH3CHO$\stackrel{Ņ»¶ØĢõ¼ž}{”ś}$
+CH3CHO$\stackrel{Ņ»¶ØĢõ¼ž}{”ś}$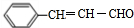 +H2O£®
+H2O£®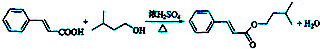 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
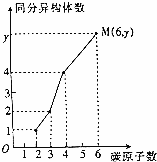 ·Ö×ÓŹ½ĪŖC2H4O2”¢C3H6O2”¢C4H8O2”¢C6H12O2ĖÄÖÖĪļÖŹ¾łŹōÓŚõ„£¬ĘäĢ¼Ō×ÓŹżÓėĶ¬·ÖŅģ¹¹ĢåµÄ¹ŲĻµČēĶ¼£¬ŌņyÖµĪŖ£Ø””””£©
·Ö×ÓŹ½ĪŖC2H4O2”¢C3H6O2”¢C4H8O2”¢C6H12O2ĖÄÖÖĪļÖŹ¾łŹōÓŚõ„£¬ĘäĢ¼Ō×ÓŹżÓėĶ¬·ÖŅģ¹¹ĢåµÄ¹ŲĻµČēĶ¼£¬ŌņyÖµĪŖ£Ø””””£©| A£® | 16 | B£® | 18 | C£® | 19 | D£® | 20 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ČżøöÉÕ±ÖŠ¾ł»į·¢ÉśµÄĄė×Ó·“Ó¦ĪŖ2Na+2H2OØT2Na++2OH-+H2”ü | |
| B£® | ČżøöÉÕ±ÖŠÄĘ¾łŌŚŅŗĆęÉĻ¾ēĮŅ·“Ó¦£¬ĒŅXÉÕ±ÖŠ·“Ó¦×ī¾ēĮŅ | |
| C£® | ČżøöÉÕ±·“Ó¦ŗó£¬Éś³ÉµÄČÜÖŹµÄĪļÖŹµÄĮæÅضČĻąĶ¬ | |
| D£® | ČżøöÉÕ±·“Ó¦ŗó£¬Éś³ÉµÄĘųĢåµÄÖŹĮæŅ»¶ØĻąĶ¬ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
 ÄņĖŲ[CO£ØNH2£©2]ŹĒŹ×øöÓÉĪŽ»śĪļČĖ¹¤ŗĻ³ÉµÄÓŠ»śĪļ
ÄņĖŲ[CO£ØNH2£©2]ŹĒŹ×øöÓÉĪŽ»śĪļČĖ¹¤ŗĻ³ÉµÄÓŠ»śĪļ²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com