
【题目】甲醇是一种重要的试剂,氢气和二氧化碳在一定条件下可合成甲醇:CO2(g)+3H2 (g) ![]() CH3 OH(g)+H2O(g),在密闭容器中充入3mol氢气和1mol二氧化碳,测得混合气体中甲醇的体积分数与温度的关系如图A所示:
CH3 OH(g)+H2O(g),在密闭容器中充入3mol氢气和1mol二氧化碳,测得混合气体中甲醇的体积分数与温度的关系如图A所示:
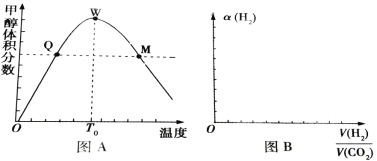
试回答下列问题:
(1)该反应是______(填“放热”或“吸热”)反应。该反应平衡常数的表达式是:______,为了降低合成甲醇的成本可采用的措施是______(任意写一条合理的建议)
(2)解释0~T0内,甲醇的体积分数变化趋势:______。
(3)氢气在Q点的转化率______(填“大于”、“小于”或“等于”,下同)氢气在W点的转化率______;其它条件相同,甲醇在Q点的正反应速率______甲醇在M点的正反应速率。
(4)图B表示氢气转化率α(H2)与投料比![]() 的关系,请在图B中画出两条变化曲线并标出曲线对应的条件,两条曲线对应的条件分别为:一条曲线对应的压强是1.01×105Pa;另一条曲线对应的压强是3.03×105Pa(其它条件相同)
的关系,请在图B中画出两条变化曲线并标出曲线对应的条件,两条曲线对应的条件分别为:一条曲线对应的压强是1.01×105Pa;另一条曲线对应的压强是3.03×105Pa(其它条件相同)
【答案】
(1)放热;![]() ;增加CO2的充入量
;增加CO2的充入量
(2)温度低于T0时,反应未达到平衡,反应正向进行,使甲醇的体积分数逐渐增大
(3)小于;小于
(4)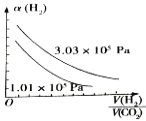 ;
;
【解析】
试题分析:(1)T0时,升高温度,甲醇的体积分数减小,平衡逆向移动,正反应为放热反应;该反应平衡常数的表达式为![]() ,为了降低合成甲醇的成本,应该尽可能的使平衡向右移动,可采用的措施有增加CO2的充入量等,故答案为:放热;
,为了降低合成甲醇的成本,应该尽可能的使平衡向右移动,可采用的措施有增加CO2的充入量等,故答案为:放热;![]() ;增加CO2的充入量;
;增加CO2的充入量;
(2)温度低于T0时,反应未达到平衡,反应正向进行,使甲醇的体积分数逐渐增大,故答案为:温度低于T0时,反应未达到平衡,反应正向进行,使甲醇的体积分数逐渐增大;
(3)温度低于T0时,反应未达到平衡,反应正向进行,氢气在Q点的转化率小于平衡时的转化率,W点打到平衡,因此氢气在Q点的转化率小于W点的转化率;平衡之前,甲醇的正反应速率逐渐增大,甲醇在Q点的正反应速率小于W点的反应速率,升高温度,反应速率增大,甲醇在M点的正反应速率大于W点,因此甲醇在Q点的正反应速率小于在M点的正反应速率,故答案为:小于;小于;
(4)根据方程式,增大压强,平衡正向移动,氢气转化率α(H2)增大,增大投料比![]() ,氢气转化率α(H2)减小,因此图像为
,氢气转化率α(H2)减小,因此图像为 ,故答案为:
,故答案为: 。
。


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】(1)6.02×1023个氢氧根离子的物质的量是________mol,其摩尔质量为________。
(2)在标准状况下,0.01 mol某气体的质量为0.44 g,则该气体的密度为________g·L1(保留小数点后两位),该气体的相对分子质量为________。
(3)在标准状况下,由CO和CO2组成的混合气体为6.72 L,质量为12 g,此混合物中CO和CO2物质的量之比是________,CO的体积分数是________,CO的质量分数是________,C和O原子个数比是________,混合气体的平均相对分子质量是________,密度是________g·L1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A.合金材料中可以含有非金属元素
B.三大合成材料是指人造纤维、塑料和橡胶
C.加热能杀死非典冠状病毒,是因为病毒中的蛋白质受热变性
D.在汽车排气管上加装“催化转化器”是为了减少有害气体的排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)为了求某NaHCO3、Na2CO3混合物中NaHCO3的质量分数,现将m1g样品加热至质量恒定时停止加热,此时质量为m2g,已知加热时发生的反应式是2NaHCO3![]() Na2CO3+CO2↑+H2O,则NaHCO3的质量分数是_________。
Na2CO3+CO2↑+H2O,则NaHCO3的质量分数是_________。
(2)臭氧层是地球生命的保护神,臭氧比氧气具有更强的氧化性。实验室可将氧气通过高压放电来制取臭氧:3O2![]() 2O3。将8L氧气通过放电管后,恢复到原状况,得到气体是6.5L,其中臭氧是_____ L。
2O3。将8L氧气通过放电管后,恢复到原状况,得到气体是6.5L,其中臭氧是_____ L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐是优良的多功能水处理剂。某实验小组釆用如图装置制备高铁酸钾(K2FeO4)并探究其性质用途。

Ⅰ.制备K2FeO4(夹持、加热等装置略)
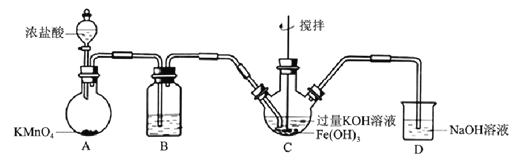
(1)B中所用试剂为______________________。
(2)C中反应为放热反应,而反应温度须控制在0~8℃,可使用的控温方法为___________,充分反应后得到紫色固体,反应方程式为___________。反应中KOH必须过量的原因是___________。
(3)C中混合物经过滤、洗涤、干燥,得纯浄髙铁酸钾晶体,洗涤时洗涤剂可选用___________。
a.冰水 b.KOH溶液 c.异丙醇
Ⅱ.探究K2FeO4的性质
(4)K2FeO4可以将废水中的CN-氧化为CNO-,实验表明,pH=9时CN-去除效果最佳。配平反应离子方程式:____FeO42-+____CN-+____H2O→____Fe(OH)3↓+____CNO-+___OH-。
现处理含CN-离子浓度为13mg/L的废水1m3,至少需要K2FeO4___________g。
(5)资料表明,酸性溶液中氧化性FeO42->MnO4-。验证实验:将少K2FeO4溶解在过量KOH溶液中,溶液呈浅紫色,取该溶液滴入MnSO4和H2SO4的混合溶液中,振荡,溶液颜色仍然呈浅紫色。请设计实验证明最后所得浅紫色溶液中含有MnO4-___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有两种金属混合物3.4g,与足量的盐酸反应放出H22.24L(标况下),这两种金属可能是
A. 铜和铁 B. 镁和铝 C. 锌和铝 D. 锌和铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
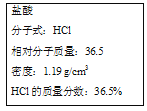
(1)该浓盐酸中HCl的物质的量浓度为_____ mol/L。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是___。
A.溶液中HCl的物质的量 B.溶液的浓度 C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol/L的稀盐酸。该学生需要量取___mL上述浓盐酸进行配制。
(4)①假设该同学成功配制 了0.400 mol/L的盐酸,他又用该盐酸中和含0.4 g NaOH的NaOH溶液,则该同学需取____ mL盐酸。
②假设该同学用新配制的盐酸中和含0.4 g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是_____。
A.浓盐酸挥发,浓度不足 B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某些植物树叶提取的挥发油中含有下列主要成分:

(1)B、C中互不相同官能团的名称分别为:_______、_______
(2)有关A、B、C三种物质的说法正确的是_______ (填序号)
a.均能发生加聚反应 b.只有B能与FeCl3发生显色反应
c.均不能与碳酸钠溶液反应 d.只有C能发生银镜反应
(3)A中苯环上的一卤代物的同分异构体的数目为________
(4)0.5mol B与足量的溴水充分反应,消耗_______ mol单质溴,其反应类型为:_______、______。
(5)己知: R1CH=CHR2![]() R1COOH+R2COOH.
R1COOH+R2COOH.
有机物C9H8O发生如下反应:
C9H8O ![]()
![]()
则C9H8O的结构简式为_______________。
(6)写出A与B在一定条件下相互反应,生成高分子化合物的化学方程式:__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水煤气 (主要成分CO、H2 ) 是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C (s) + H2O(g)![]() CO (g) +H2 (g);△H =+131.3kJmol-1
CO (g) +H2 (g);△H =+131.3kJmol-1
(1)某温度下,四个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
容器编号 | c(H2O)/mol·L-1 | c(CO)/mol·L-1 | c(H2)/mol·L-1 | V正、V逆比较 |
I | 0.06 | 0.60 | 0.10 | V正=V逆 |
II | 0.06 | 0.50 | 0.40 | (_________) |
III | 0.12 | 0.40 | 0.80 | V正<V逆 |
IV | 0.12 | 0.30 | _________ | V正=V逆 |
(2)另有一个容积可变的密闭容器。恒温恒压下,向其中加入1.0mol炭和 1.0mo l水蒸气 (H216O),发生上述反应,达到平衡时,容器的体积变为原来的1.25 倍。平衡时水蒸气的转化率为___________;向该容器中补充 a mol 炭,水蒸气的转化率将____________(填 “增大”、“减小”、“不变”),再补充 a mol 水蒸气 (H218O), 最终容器中C16O和C18O 的物质的量之比为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com