
【题目】某学生为探究金属Al在酸性或碱性溶液中均可与NO3-发生氧化还原反应,进行如下实验:
①将Al加入到pH=2的HNO3溶液中,Al溶解,得到溶液A,产生无色气体C,气体C在空气中转化为红棕色气体E;
②将Al 加入到pH=12的KNO3和KOH混合溶被中,Al溶解,得到溶液B,产生无色有刺激性气味的气体D;
③在A溶液中通入气体D,最终产生大量的白色沉淀;
④在B溶液中通入气体E,先出现白色沉淀,而后白色沉淀溶解。
请回答下列问题:
(1)Al与NO3-在酸性条件下反应,Al与被还原的NO3-的物质的量之比是_______。
(2)E和D在一定条件下反应生成两种对环境无污染的物质,则该反应的化学方程式为_______。
(3)已知A和B两溶液混合产生白色沉淀,该反应的离子方程式为_______。
(4)以Al和Fe作电极,在碱性、NO3-存在条件下形成原电池,则Fe电极反应式为_______。
(5)除去气体C中混有的少量E的操怍是_______。
【答案】 1:1 8NH3 +6NO2 ![]() 7N2+12H2O Al3+ +3AlO2- +6H2O=4A1(OH)3↓ NO3- +8e- +6H2O=9OH- +NH3↑ 将气体通过盛有水的洗气瓶
7N2+12H2O Al3+ +3AlO2- +6H2O=4A1(OH)3↓ NO3- +8e- +6H2O=9OH- +NH3↑ 将气体通过盛有水的洗气瓶
【解析】试题分析:本题通过探究Al与NO3-在酸性或碱性溶液中的反应为载体,考查氧化还原反应的分析,电极反应式和方程式的书写,涉及Al及其化合物的转化、N及其化合物的转化。
(1)根据①,Al与NO3-在酸性条件下反应得到溶液A和无色气体C,C在空气中转化为红棕色气体E,则溶液A为Al(NO3)3溶液,C为NO,E为NO2;反应的化学方程式为:Al+4HNO3(稀)=Al(NO3)3+NO↑+2H2O,在反应中Al元素的化合价由0升至+3价,N元素的化合价由NO3-中+5价降至NO中+2价,根据得失电子守恒,3n(Al)=3n(NO3-)被还原,n(Al):n(NO3-)被还原=1:1。
(2)根据②,Al 加入到pH=12的KNO3和KOH混合溶被中,Al溶解得到溶液B,产生无色有刺激性气味的气体D,结合③A溶液中通入气体D产生大量白色沉淀,④B溶液中通入气体NO2先出现白色沉淀而后白色沉淀溶解,则溶液B为KAlO2溶液,无色有刺激性气味的气体D为NH3,反应的化学方程式为:8Al+5KOH+3KNO3+2H2O=8KAlO2+3NH3↑。NO2和NH3在一定条件下反应生成两种对环境无污染的物质,两种生成物为N2和H2O,则反应的化学方程式为:8NH3 +6NO2![]() 7N2+12H2O。
7N2+12H2O。
(3)A为Al(NO3)3溶液,B为KAlO2溶液,两者混合发生双水解反应,反应的离子方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓。
(4)碱性条件下自发发生的氧化还原反应为:8Al+5KOH+3KNO3+2H2O=8KAlO2+3NH3↑,Al为负极,Al电极电极反应式为:Al-3e-+4OH-=AlO2-+2H2O;Fe为正极,Fe电极电极反应式为NO3-+8e-+6H2O=NH3↑+9OH-。
(5)C为NO,E为NO2,除去NO中混有的NO2的操作是:将气体通过盛有水的洗气瓶,发生的反应为3NO2+H2O=2HNO3+NO。


 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】某校化学研究性学习小组设计如下实验方案,测定NaHCO3和Na2CO3混合物中NaHCO3的质量分数。按下图装置进行实验。并回答以下问题。
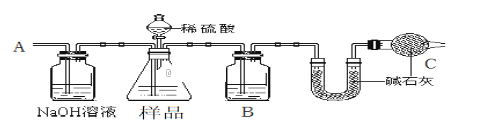
①按图组装仪器并检查装置的气密性。
②实验前称取17.90g样品,从分液漏斗滴入6mol·L-1的硫酸,直到不再产生气体时为止, 从导管A处缓缓鼓入一定量的空气。
③实验结束后测得U型管增重 8.80g。
(1)B瓶中装的试剂为___________________,C装置的作用是___________________________。
(2)从导管A处缓缓鼓入一定量的空气的目的是_______________________。
(3)该样品中NaHCO3的质量分数为_______________________(保留三位有效数字)。
(4)现有等物质的量浓度的NaHCO3溶液和Na2CO3溶液各一瓶,请选择正确的方法进行鉴别____。
A.加热法:产生使澄清石灰水变浑浊气体的是NaHCO3
B.沉淀法:加入BaCl2溶液,产生沉淀的是Na2CO3溶液
C.气体法:逐滴加入盐酸,立即产生气泡的是NaHCO3溶液
D.测pH法:用pH试纸测其pH,pH大的是Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列物质在水中的电离方程式
碳酸氢钠______________________________________________________________。
亚硫酸________________________________,______________________________。
(2)已知25 ℃时有关弱酸的电离平衡常数如下:HCN:4.9×10-10,H2CO3:K1=4.4×10-7 K2=4.7×10-11,向NaCN溶液中通入少量二氧化碳气体,写出发生反应的离子方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用品的主要成分不正确的是
A | B | C | D | |
用品 | 水玻璃 | “84”消毒液 | 小苏打 | 光导纤维 |
主要成分 | Na2SiO3 | NaClO | NaHCO3 | Si |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸. 
(1)B中Sn极上出现的现象
(2)C中Zn片上的电极反应式为;
(3)A、B、C中铁溶解的速率由快到慢的顺序是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列材料的主要成分为同主族元素形成的无机非金属材料的是( )
A.“玉兔二号”铁合金筛网轮B.医用聚乙烯无纺布防护服
C.酚醛树脂手柄D.大口径碳化硅反射镜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A.反应物的总能量低于生成物的总能量时,该反应一定不能发生
B.强酸跟强碱反应放出的热量一定是中和热
C.由反应C(金刚石,s)═C(石墨,s)△H<0,可知石墨比金刚石稳定
D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)═2H2O(l)△H=﹣285.8 kJmol﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com