
【题目】下列操作过程中一定有氧化还原反应发生的是( )
A. 蒸发氯化钠溶液 B. 将盐酸滴入碳酸钠溶液中
B. 将盐酸滴入碳酸钠溶液中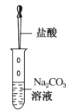 C. 蔗糖溶解
C. 蔗糖溶解 D. 磷在氧气中燃烧
D. 磷在氧气中燃烧
【答案】D
【解析】
A.加热NaCl溶液时液态水转化为水蒸气,溶剂量不断减少,NaCl逐渐析出晶体,这些过程都是物理变化,没有氧化还原反应发生,A项错误;
B.将盐酸滴入Na2CO3溶液中依次发生反应:Na2CO3+HCl=NaHCO3+NaCl,NaHCO3+HCl=NaCl+CO2↑+H2O, 这两个反应中各元素化合价均无变化,不是氧化还原反应,B项错误;
C.蔗糖溶解于水时,在水分子的作用下蔗糖分子扩散到水里,这个过程属于物理变化,没有氧化还原反应发生,C项错误;
D.磷在氧气燃烧,发生反应的化学方程式为4P+5O2![]() 2P2O5,该反应中磷元素的化合价由单质中的0价升高到P2O5中的+5价,氧元素化合价由单质中的0价降到P2O5中的-2价,所以该反应属于氧化还原反应,D项正确;答案选D。
2P2O5,该反应中磷元素的化合价由单质中的0价升高到P2O5中的+5价,氧元素化合价由单质中的0价降到P2O5中的-2价,所以该反应属于氧化还原反应,D项正确;答案选D。


科目:高中化学 来源: 题型:
【题目】某科研小组公司开发了Li-SO2Cl2军用电池,其示意图如下图所示,已知电池总反应为:2Li+ SO2Cl2= 2LiCl+SO2↑。下列叙述中错误的是
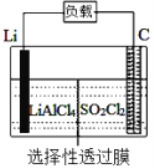
A. 电池工作时负极材料是Li,发生氧化反应
B. 电池工作时电子流向:锂电极→导线→负载→碳棒
C. 电池工作时,外电路流过0.2 mol电子,标准状况下生成4.48 L气体
D. 电池工作过程中,石墨电极反应式为SO2Cl2+2e-=2Cl-+SO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1 mol的镁、铝混合物溶于100 mL、2 mol·L-1的H2SO4溶液中,然后再滴加1 mol·L-1的NaOH溶液。请回答:
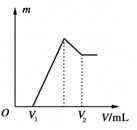
(1)若在滴加NaOH溶液的过程中沉淀质量m随加入NaOH溶液的体积V变化如上图所示。当V1=160 mL时,则金属粉末中n(Mg)=________mol,V2=________ mL。
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=________ mL。
(3)若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL、2 mol·L-1的H2SO4溶解此混合物后,再加入450 mL、1 mol·L-1的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl样品中含有少量的Na2SO4和Na2CO3,按下列流程进行净化。
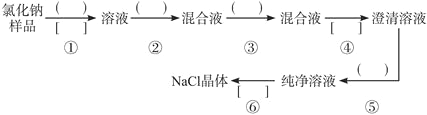
(1)流程第②③步中应分别使用________、_________试剂,第⑥步中应进行_________操作
(2)写出第⑤步发生反应的化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雷尼镍(Raney-Ni)是一种多孔结构的镍铝合金,对氢气具有强吸附性,是烯烃、炔烃氢化反应的高效催化剂。一种以铜镍渣(主要含Cu、Fe、Co和Ni)生产雷尼镍的流程如下:
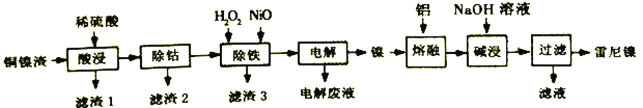
下表列出了有关金属离子生成氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.3 | 9.9 | 9.2 |
(1)“酸浸”时,如通入空气并不断搅拌,可将“滤渣1”氧化溶解,离子方程式为___________。
(2)“除铁”时,先加入适量H2O2氧化Fe2+,理论上消耗的n(H2O2):n(Fe2+)=____;再加入NiO以调节溶液的pH。应控制pH的范围为__________________。
(3)“电解”(以惰性材料作电极)是为了获得单质镍。电解产物中可循环利用的物质是_______。
(4)“碱浸”是为了形成多孔结构的雷尼镍,反应的离子方程式为_________________。使用新制雷尼镍进行氢化反应时,不加氢气也可实现氢化的目的,原因是____________________。
(5)“滤液”主要成分与过量CO2反应的离子方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
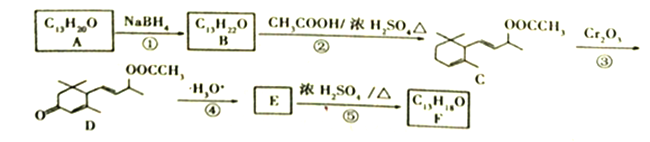
【题目】【题目】工业合成有机物F的路线如下:
已知:①![]() ;
;
②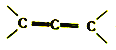 结构不稳定,不子考虑。
结构不稳定,不子考虑。
(1)A中含氧官能团的名称为_______________;C→D反应③的类型为_____________。
(2)化合物B的结构简式为__________;F与Br2按物质的量之比1:1加成所得产物有____种。
(3)E→F的化学方程式为___________________________。
(4)上述转化关系中,设计步骤②和④的目的是______________________________________。
(5)H是A的同分异构体,任写一种满足以下条件的H的结构简式________________。
①与FeCl3溶液发生显色反应。
②核磁共振氢谱有5组峰,且峰面积之比为1:2:2:3:12。
(6)参照上述合成路线,设计并写出用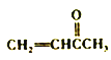 合成聚1.3-丁二烯的路线流程图(无机试剂任选)。 ______________________________
合成聚1.3-丁二烯的路线流程图(无机试剂任选)。 ______________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验现象所得出的结论中,正确的是( )
A. 无色溶液中加入稀盐酸产生无色无味气体,该气体能使澄清石灰水变浑浊,结论:原溶液可能含有CO32-
B. 某物质焰色反应呈黄色,结论:该物质是钠盐
C. 无色试液加入NaOH溶液,加热产生的气体使红色石蕊试纸变蓝,结论:试液中含NH3
D. 无色溶液中加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,结论:原溶液一定含有SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中富含碘元素.从海带中提取碘有如下步骤:( ) ①将海带焙烧成灰(生成KI) ②加水使KI溶解,充分搅拌后过滤 ③在滤液通入足量Cl2
④加CCl4振荡 ⑤静置后,用分液漏斗分液 合理的操作顺序是.
A.①②③④⑤
B.②⑤①③④
C.①③⑤②④
D.②①③⑤④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com