
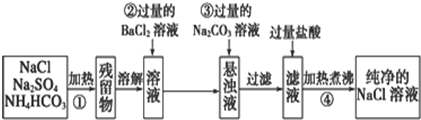
分析 NH4HCO3可通过加热分解而除去;硫酸钠中硫酸根离子 可通过加氯化钡溶液除去,然后加入过量的碳酸钠溶液除去上一步过量的钡离子,过滤后加入盐酸除去过量的碳酸钠,再题干加热煮沸除去氯化氢,从而可得纯净的氯化钠溶液,据此结合题给框图形式进行解答.
解答 解:NH4HCO3可通过加热分解而除去;硫酸钠中硫酸根离子 可通过加氯化钡溶液除去,然后加入过量的碳酸钠溶液除去上一步过量的钡离子,过滤后加入盐酸除去过量的碳酸钠,再题干加热煮沸除去CO2气体和HCl,从而可得纯净的NaCl溶液,
(1)贴上去阿玉不稳定,硫酸钠和NaCl比较稳定,可通过加热的方法除去碳酸氢铵,反应方程式为:NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO2↑+H2O,
故答案为:NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO2↑+H2O;
(2)若选用Ba(NO3)2溶液会引入新的杂质离子NO3-,所以操作②中BaCl2溶液不能改用硝酸钡溶液,
故答案为:不能;选用Ba(NO3)2溶液会引入新的杂质离子NO3-;
(3)操作②加入了过量的氯化钡,反应后混合液中含有杂质钡离子,则操作③加入过量的碳酸钠溶液,目的是除去过量的Ba2+,
故答案为:除去过量的Ba2+;
(4)向过滤后的滤液中加入过量盐酸后,混合液中含有二氧化碳和HCl气体,选用通过加热煮沸除去,所以操作④的目的是除去溶解在溶液中的CO2气体和HCl,
故答案为:除去溶解在溶液中的CO2气体和HCl.
点评 本题考查了物质的分离与提纯方法的综合应用,题目难度中等,明确常见物质的性质为解答关键,注意掌握化学实验基本操作方法,试题培养了学生的化学实验能力.


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 氢氧化镁 | 银 | |
| 化学式 | HNO3 | Mg(OH)2 | |
| 类别 | 酸 | 单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
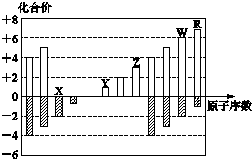
| A. | 离子半径:Z>Y>X | |
| B. | 最高正价氧化物对应的水化物的酸性:R<W | |
| C. | 氢化物的还原性:R>W | |
| D. | R的单质能与W的氢化物反应,可证明非金属性:R>W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com