
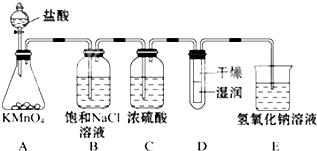
 工业上将纯净干燥的氯气通入到0.5mol•L-1NaOH溶液中得到漂白水.某同学想在实验室探究Cl2性质并模拟制备漂白水,如图是部分实验装置.已知KMnO4与浓盐酸反应可以制取Cl2.(注:装置D中布条为红色)
工业上将纯净干燥的氯气通入到0.5mol•L-1NaOH溶液中得到漂白水.某同学想在实验室探究Cl2性质并模拟制备漂白水,如图是部分实验装置.已知KMnO4与浓盐酸反应可以制取Cl2.(注:装置D中布条为红色)分析 (1)使用分液漏斗时应取下塞子,使分液漏斗内的压强等于大气压强,保证液体顺利流出;
(2)分析元素中化合价变化,依据氧化还原反应得失电子守恒、原子个数守恒配平方程式;
(3)浓盐酸易挥发,制取的氯气中含有氯化氢和水蒸气,氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,所以利用饱和食盐水除去氯气中混有的氯化氢气体,减小氯气溶解度,浓硫酸具有吸水性,能够干燥氯气;氯气有毒,直接排放能够引起污染,需要进行尾气处理;
(4)依据氯气与二氧化硫在水溶液中发生氧化还原反应生成盐酸和硫酸结合硫酸和盐酸无漂白性解答;
(5)配制450mL溶液,应选择500ml容量瓶,依据m=CVM计算需要氢氧化钠的质量.
解答 解:(1)使用分液漏斗时应取下塞子,使分液漏斗内的压强等于大气压强,保证液体顺利流出,打开分液漏斗,发现其中的液体不能流下,可能的原因是分液漏斗瓶塞未打开;
故答案为:分液漏斗上端活塞未打开;
(2)反应中高锰酸钾中+7价锰降为氯化锰中+2价,高锰酸钾做氧化剂,氯化氢中-1价氯部分升高为氯气中0价,氯化氢做还原剂,依据得失电子守恒,则氯气系数为5,高锰酸钾系数为2,依据原子个数守恒,反应方程式:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8 H2O;反应中消耗2mol高锰酸钾,则有10mol氯化氢被氧化,所以氧化剂和还原剂的物质的量之比为1:5;
故答案为:2;16;2;2;5;8; 1:5;
(3)浓盐酸易挥发,制取的氯气中含有氯化氢和水蒸气,氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,所以利用饱和食盐水除去氯气中混有的氯化氢气体,减小氯气溶解度,浓硫酸具有吸水性,能够干燥氯气;氯气有毒,直接排放能够引起污染,需要进行尾气处理,氯气能够与氢氧化钠溶液反应,可以用装有氢氧化钠溶液的E吸收过量的氯气;
故答案为:吸收Cl2中的HCl;吸收Cl2中的H2O;吸收尾气,防止污染空气;
(4)氯气与二氧化硫在水溶液中发生氧化还原反应生成盐酸和硫酸,反应的化学方程式为:SO2+Cl2+2H2O=H2SO4+2HCl,盐酸和硫酸不具有漂白性,
故答案为:SO2+Cl2+2H2O=H2SO4+2HCl;
(5)配制450mL溶液,应选择500mL容量瓶,需称量的NaOH的质量为:0.4mol•L-1×0.5L×40g/mol=8.0g,
故答案为:500 mL容量瓶;8.0 g.
点评 本题考查了氯溴碘的性质实验,题目难度中等,涉及氧化还原反应的配平、一定物质的量浓度溶液的配制、化学方程式书写等知识,明确氯气的制备原理和性质是解题关键,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | Na | B. | Mg | C. | Cu | D. | Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 2NH3(g)△H=-92kJ/mol.
2NH3(g)△H=-92kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④②⑤③ | B. | ④①②⑤③ | C. | ②⑤④①③ | D. | ④⑤②①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
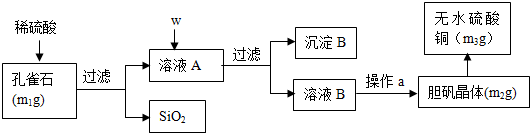
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
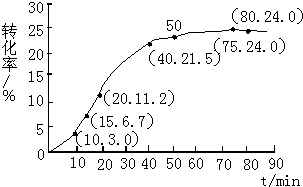 甲酸甲酯水解反应方程式为:
甲酸甲酯水解反应方程式为:| 组分 | HCOOCH3 | H2O | HCOOH | CH3OH |
| 物质的量/mol | 1.00 | 1.99 | 0.01 | 0.52 |
| 反应时间范围/min | 0~5 | 10~15 | 20~25 | 30~35 | 40~45 | 50~55 | 75~80 |
| 平均反应速率/(10-3mol•min-1) | 1.9 | 7.4 | 7.8 | 4.4 | 1.6 | 0.8 | 0.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
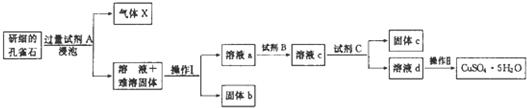
| 物质 | Fe(OH)3 | Cu(OH)2 |
| 开始沉淀时的pH | 2.3 | 4.8 |
| 完全沉淀时的pH | 3.7 | 6.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com