
| A. | 蔗糖在硫酸催化下水解,只生成葡萄糖 | |
| B. | 石油的裂解、煤的干馏都是化学变化 | |
| C. | 1L1mol•L-1AlCl3溶液中含Al3+数目为6.02×1023 | |
| D. | 等质量的铝粉按a、b两种途径完全转化,途径a比途径b消耗更多的NaOH 途径a:Al$→_{点燃}^{O_{2}}$Al2O3$\stackrel{NaOH溶液}{→}$NaAlO2;途径b:Al$\stackrel{NaOH溶液}{→}$NaAlO2 |
分析 A.蔗糖水解生成葡萄糖和果糖;
B.有新物质生成的变化是化学变化,没有新物质生成的变化是物理变化;
C.氯化铝为强酸弱碱盐,铝离子水解;
D.根据途径a、b的反应方程式中铝粉与NaOH的关系解答.
解答 解:A.蔗糖在一定条件下发生水解反应:C12H22O11(蔗糖)+H2O$\stackrel{稀酸}{→}$C6H12O6(葡萄糖)+C6H12O6(果糖),故A错误;
B.石油的裂解、裂化及煤的干馏都有新物质生成,属于化学变化,故B正确;
C.氯化铝在溶液中,铝离子水解,所以1L1mol•L-1AlCl3溶液中含Al3+数目小于6.02×1023,故C错误;
D.途径a:4Al+3O2$\frac{\underline{\;点燃\;}}{\;}$2Al2O3,Al2O3+2NaOH═2NaAlO2+H2O,2mol铝需2mol氢氧化钠,途径b:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,2mol铝需2mol氢氧化钠,途径a与途径b消耗的NaOH一样多,故D错误.
故选B.
点评 本题考查较综合,涉及蔗糖水解、物质的变化类别、盐的水解、偏铝酸钠的制备等知识,注意D为易错点,题目难度不大,注意知识的积累.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
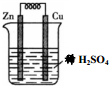
| A. | 铜片是正极 | B. | 锌片质量逐渐减少 | ||
| C. | 电子从锌片经溶液流向铜片 | D. | 正极的电极反应式:2H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
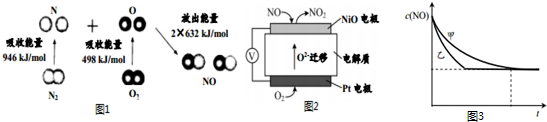
| 实验编号 | t (℃) | NO初始浓度 | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.2×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 280 | 1.2×10-3 | b | 124 |
| Ⅲ | 350 | a | 5.8×10-3 | 82 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2通入溴水中:SO2+2H2O+Br2═2H++SO42-+2HBr | |
| B. | 向漂白粉稀溶液中通入过量CO2:ClO-+CO2+H2O═HClO+HCO3- | |
| C. | NaHSO4溶液和Ba(OH)2溶液充分反应后溶液显中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com