
��6�֣�25��ʱ��KSP[Mg��OH��2]=5.6��10-12, KSP[MgF2]=7.42��10-11,�ڸ��¶��½�������ʵ��,�ش��������:
(1)��ͬŨ�ȵĺ�OH-��F-����Һ��,��μ�MgCl2��Һʱ,���Ȳ����ij�����____��____
(2)Mg(OH)2����Һ��ŨNH4Cl��Һ,�Խ��Ͳ����������ԭ��___��___�������ӷ���ʽ��ʾ��
(3)������Ϊ�������β��ܺͼ���Һ�������ֽⷴӦ��������MgF2����Һ�еμ�NaOH��Һ���ܷ�����ѧ��Ӧ��������Ϊ�ܷ�Ӧ�ģ���д���÷�Ӧ�����ӷ���ʽ��������Ϊ���ܷ�Ӧ����˵�����ɡ�____��____
 ����ѧ��ţ��Ӣ��ϵ�д�
����ѧ��ţ��Ӣ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
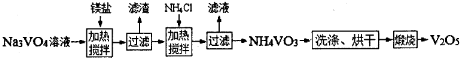
 25��ʱ��ij�����Լ�MOH��ˮ�еij����ܽ�ƽ��������ͼ��ʾ����λ��mol?L-1��������˵����ȷ���ǣ�������
25��ʱ��ij�����Լ�MOH��ˮ�еij����ܽ�ƽ��������ͼ��ʾ����λ��mol?L-1��������˵����ȷ���ǣ��������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��17�֣����ô�������Ӧ��SO2ת��ΪSO3�ǹ�ҵ����������Ĺؼ����衣
��1��ij�¶��£�2SO2��g��+O2��g�� 2S03��g����H3=mkJ/mol��ƽ�ⳣ����K���Ĵ�С���¶ȣ�T���Ĺ�ϵ����ͼ��������ʾ����m____0���>����=����<������b��ʱv������ v���棩���<������=����>��������Ӧ���ʱ䣨��H���� �����������С�����䡱����
2S03��g����H3=mkJ/mol��ƽ�ⳣ����K���Ĵ�С���¶ȣ�T���Ĺ�ϵ����ͼ��������ʾ����m____0���>����=����<������b��ʱv������ v���棩���<������=����>��������Ӧ���ʱ䣨��H���� �����������С�����䡱����
��2������Ӧ����ʼ�����ʵ�����ͬ�����й�ϵͼ����ȷ���� ������ţ���
��3��ij���᳧����SO2β��������м��������ˮ�ϳ��̷���FeS04��7H2O������Ӧ������ԭ���������� ��
��4������Ӧ��Ļ�������ð�ˮ���տɵõ���NH4��2SO3�ͣ�NH4��2SO4���ֻ���ԭ�ϡ�
�ٶ��ڣ�NH4��2SO3��Һ��ijͬѧд�������µ���ȷ��ϵʽ��
2[c��SO2-3��ʮc��HSO-3��+c��H2SO3��]=c��NH+4��+c��NH3��H2O��
�������ͬѧ�������� ��
���ڣ�NH4��2 SO4��Һ�д��ڣ�NH+4+H2O NH3��H2O+H+����÷�Ӧ�����µ�ƽ�ⳣ��K= ����֪�������£�NH3��H2O�ĵ���ƽ�ⳣ��K=1. 7��10-5��
NH3��H2O+H+����÷�Ӧ�����µ�ƽ�ⳣ��K= ����֪�������£�NH3��H2O�ĵ���ƽ�ⳣ��K=1. 7��10-5��
��5�������������պ����õ����᳣�����Ʊ�BaSO4��X������ʱ���ڷ���Ӱ����θ���ǿ��pHԼΪ1���������ô���BaSO4��Ȼ�ǰ�ȫ�ģ�BaSO4���������ԭ���ǣ����ܽ�ƽ��ԭ�����ͣ� ����һ���������BaCO4��Ӧ�����ô���0. 5mol/LNa2SO4��Һ������ϴθ���������ϴθ������Na2SO4��ҺŨ�ȵı仯��������θҺ�е�Ba2+Ũ�Ƚ�Ϊmol/L����֪25��ʱ��Ksp��BaSO4��=1��l0-10 ,Ksp��BaCO3��=1��10-9��.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010��ӱ�ɳ��һ�п�ǰ�������ۻ�ѧ�������� ���ͣ������
���ô�������Ӧ��SO2ת��ΪSO3�ǹ�ҵ����������Ĺؼ����衣
��1��ij�¶��£�2SO2��g���� O2��g�� 2SO3��g������H��mkJ��mol��1
2SO3��g������H��mkJ��mol��1
K�Ĵ�С���¶ȣ�T���Ĺ�ϵ����ͼ��������ʾ����m 0���������=����������
b��ʱv������ v���棩�������������������������Ӧ���ʱ䣨��H���� �����������С�����䡱����
��2������Ӧ����ʼ�����ʵ�����ͬ�����й�ϵͼ�������________ (�����)��

��3��ij���᳧����S02β��������м��������ˮ�ϳ��̷���FeS04��7H20������Ӧ������ԭ���������� ��
��4������Ӧ��Ļ�������ð�ˮ���տɵõ� (NH4)2SO3��(NH4)2SO4���ֻ���ԭ��
�ٶ���(NH4)2SO3��Һ��ijͬѧд�������µ���ȷ��ϵʽ��
2[c(SO32��)��c(HSO3��)��c(H2SO3)]=c(NH4��)��c(NH3��H2O)
�������ͬѧ��������
����(NH4)2SO4��Һ�д��ڣ�NH4����H2O NH3��H2O��H������÷�Ӧ�����µ�ƽ�ⳣ��K= ����֪�������£�
NH3��H2O��H������÷�Ӧ�����µ�ƽ�ⳣ��K= ����֪�������£� �ĵ���ƽ�ⳣ��Kb=1.7��10��5 mol��L��1��
�ĵ���ƽ�ⳣ��Kb=1.7��10��5 mol��L��1��
��5�������������պ����õ����᳣�����Ʊ�BaSO4��X������ʱ���ڷ���Ӱ����θ���ǿ��pHԼΪ1���������ô���BaSO4��Ȼ�ǰ�ȫ�ģ�BaSO4���������ԭ���ǣ����ܽ�ƽ��ԭ�����ͣ� ����һ���������BaCO3��Ӧ�����ô���0.5mol��LNa2SO4��Һ������ϴθ���������ϴθ������Na2SO4��ҺŨ�ȵı仯��������θҺ�е�Ba2+Ũ�Ƚ�Ϊ mol��L����֪25��ʱ��Ksp��BaSO4��=l��10-10��Ksp��BaCO3��=1��l0-9����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010��ӱ�ɳ��һ�п�ǰ�������ۻ�ѧ�������� ���ͣ������
���ô�������Ӧ��SO2ת��ΪSO3�ǹ�ҵ����������Ĺؼ����衣
��1��ij�¶��£�2SO2��g����
O2��g�� 2SO3��g������H�� mkJ��mol��1
2SO3��g������H�� mkJ��mol��1
K�Ĵ�С���¶ȣ�T���Ĺ�ϵ����ͼ��������ʾ����m 0���������=����������
b��ʱv������ v���棩�������������������������Ӧ���ʱ䣨��H���� �����������С�����䡱����

��2������Ӧ����ʼ�����ʵ�����ͬ�����й�ϵͼ�������________ (�����)��


��3��ij���᳧����S02β��������м��������ˮ�ϳ��̷���FeS04��7H20������Ӧ������ԭ���������� ��
��4������Ӧ��Ļ�������ð�ˮ���տɵõ� (NH4)2SO3��(NH4)2SO4���ֻ���ԭ��
�ٶ���(NH4)2SO3��Һ��ijͬѧд�������µ���ȷ��ϵʽ��
2[c(SO32��)��c(HSO3��)��c(H2SO3)]=c(NH4��)��c(NH3��H2O)
�������ͬѧ��������
����(NH4)2SO4��Һ�д��ڣ�NH4����H2O NH3��H2O��H������÷�Ӧ�����µ�ƽ�ⳣ��K=
����֪�������£�
NH3��H2O��H������÷�Ӧ�����µ�ƽ�ⳣ��K=
����֪�������£� �ĵ���ƽ�ⳣ��Kb=1.7��10��5
mol��L��1��
�ĵ���ƽ�ⳣ��Kb=1.7��10��5
mol��L��1��
��5�������������պ����õ����᳣�����Ʊ�BaSO4��X������ʱ���ڷ���Ӱ����θ���ǿ��pHԼΪ1���������ô���BaSO4��Ȼ�ǰ�ȫ�ģ�BaSO4���������ԭ���ǣ����ܽ�ƽ��ԭ�����ͣ� ����һ���������BaCO3��Ӧ�����ô���0.5mol��LNa2SO4��Һ������ϴθ���������ϴθ������Na2SO4��ҺŨ�ȵı仯��������θҺ�е�Ba2+Ũ�Ƚ�Ϊ mol��L����֪25��ʱ��Ksp��BaSO4��=l��10-10��Ksp��BaCO3��=1��l0-9����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com