
【题目】已知![]() 和NaCl混合溶液中,
和NaCl混合溶液中,![]() 的物质的量浓度是
的物质的量浓度是![]() 的物质的量浓度的
的物质的量浓度的![]() 倍,下列叙述中正确的是
倍,下列叙述中正确的是![]()
A.溶液中一定有![]() 和3molNaCl
和3molNaCl
B.所带电荷数![]() 是
是![]() 的
的![]() 倍
倍
C.![]() 与
与![]() 的物质的量之和等于
的物质的量之和等于![]() 的物质的量
的物质的量
D.![]() 和NaCl的物质的量之比为1:3
和NaCl的物质的量之比为1:3
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡:H2O=H++OH-,下列叙述正确的是( )
A.![]() 表示的粒子不会对水的电离平衡产生影响
表示的粒子不会对水的电离平衡产生影响
B.![]() 表示的物质加入水中,促进水的电离,c(H+)增大
表示的物质加入水中,促进水的电离,c(H+)增大
C.25℃时,CH3COO-加入水中,促进水的电离,Kw不变
D.水的电离程度只与温度有关,温度越高,电离程度越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A.1molCH3CH=CH2含σ键9NA
B.14.2gC10H22含共价键个数为3.2NA
C.14g乙烯和丙烯混合气体中的氢原子数为2NA
D.标准状况下,2.24LCCl4含有的CCl4分子数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,向
时,向![]() 的NaOH溶液中逐滴加入某浓度的
的NaOH溶液中逐滴加入某浓度的![]() 溶液。滴定过程中,溶液的pH与滴入
溶液。滴定过程中,溶液的pH与滴入![]() 溶液的体积关系如图所示,点
溶液的体积关系如图所示,点![]() 时NaOH溶液恰好被中和。则下列说法中,正确的是
时NaOH溶液恰好被中和。则下列说法中,正确的是![]()
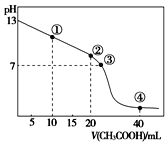
A.![]() 溶液的
溶液的![]()
B.图中点![]() 到点
到点![]() 所示溶液中,水的电离程度增大
所示溶液中,水的电离程度增大
C.点![]() 所示溶液中存在:
所示溶液中存在:![]()
D.滴定过程中会存在:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的数值,下列说法正确的是( )
A.标准状况下2.24L氯气与水充分反应转移电子数为0.1NA
B.标况下,2.24LNO2分子总数小于0.1NA
C.标准状况下2.24L的CCl4中含有的C—Cl键数为0.4NA
D.6.8g液态KHSO4中含有0.1NA个阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式能用来解释相应实验现象的是
A.铁粉溶于足量稀硝酸3Fe+8H++2NO3—=3Fe2++2NO↑+4H2O
B.三氯化铁溶液中滴入硫氯酸钾溶液出现血红色Fe3++3SCN—=Fe(SCN)3
C.饱和氯化铁溶液滴入沸水溶液呈现红褐色Fe3++3H2O=Fe(OH)3↓+3H+
D.四羟基合铝酸钠溶液与碳酸氢钠溶液混合产生白色沉淀 [Al(OH)4]—+ HCO3—=Al(OH)3↓+CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】脱落酸是一种抑制生长的植物激素,因能促使叶子脱落而得名,其结构简式如图所示,下列有关脱落酸的说法正确的是( )
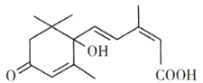
A.脱落酸的分子式为C15H18O4
B.脱落酸只能和醇发生酯化反应
C.1mol脱落酸最多可以和2mol金属钠发生反应
D.脱落酸不能使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置设计正确且能达到实验目的的是( )

A.实验装置Ⅰ:检查装置的气密性
B.实验装置Ⅱ:测定未知盐酸的浓度
C.实验装置Ⅲ:比较氯、碳、硅三种元素的非金属性强弱
D.实验装置Ⅳ:定容
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚又称甲醚,简称 DME,熔点![]() ,沸点
,沸点![]() ,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。 由合成气(
,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。 由合成气(![]() )制备二甲醚的反应原理如下:
)制备二甲醚的反应原理如下:
①![]()
②![]()
回答下列问题:
(1)已知:![]() ,若由合成气(
,若由合成气(![]() ) 制备
) 制备 ![]() ,且生成
,且生成![]() ,其热化学方程式为_______________。
,其热化学方程式为_______________。
(2)有人模拟该制备原理:500K时,在2L的密闭容器中充入![]() 和
和![]() . 5min达到平衡,平衡时测得
. 5min达到平衡,平衡时测得![]() ,
,![]() ,此时
,此时![]() 的转化率为___________。用
的转化率为___________。用 ![]() 表示反应①的速率是_____________
表示反应①的速率是_____________![]() ,可逆反应②的平衡常数
,可逆反应②的平衡常数 ![]() =_______________________
=_______________________
(3)在体积一定的密闭容器中发生反应②,如果该反应的平衡常数![]() 值变小,则下列说法正确的是_________________ 。
值变小,则下列说法正确的是_________________ 。
A. 平衡向正反应方向移动
B. 平衡移动的原因是升高了温度
C. 达到新平衡后体系的压强不变
D. 容器中![]() 的体积分数减小
的体积分数减小
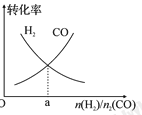
(4)一定条件下在恒温恒容的密闭容器中,按不同投料比充入![]() 和
和![]() 进行反应①,平衡时
进行反应①,平衡时![]() 和
和![]() 的转化率如图所示,则a=________ (填数值)。
的转化率如图所示,则a=________ (填数值)。
(5)用活性炭还原法处理氮氧化物的有关反应为:![]() 。向恒容密闭容器中加入一定量的活性炭和
。向恒容密闭容器中加入一定量的活性炭和![]() ,恒温(
,恒温(![]() )时,各物质的浓度随时间的变化如下表:
)时,各物质的浓度随时间的变化如下表:
浓度/ 时间/min |
|
|
|
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
40 | 0.032 | 0.034 | 0.017 |
50 | 0.032 | 0.034 | 0.017 |
在31 min时,若只改变某一条件使平衡发生移动,40 min,50 min时各物质的浓度如上表所示,则改变的条件是__________________。
在51 min时,保持温度和容器体积不变再充入![]() 和
和![]() ,使二者的浓度均增加至原来的两倍,此时化学平衡__(填“正向移动”、“逆向移动”或“不移动”)。
,使二者的浓度均增加至原来的两倍,此时化学平衡__(填“正向移动”、“逆向移动”或“不移动”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com