
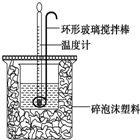
 利用如图所示装置测定中和热的实验步骤如下:
利用如图所示装置测定中和热的实验步骤如下:| 实验 序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | 氢氧化钠溶液 | 混合溶液 | |
| 1 | 20.0 | 20.1 | 23.2 |
| 2 | 20.2 | 20.4 | 23.4 |
| 3 | 20.5 | 20.6 | 23.6 |
分析 (1)为了保证酸或是碱中的一方完全反应,往往保证一方过量;
(2)将NaOH溶液倒入小烧杯中,分几次倒入,会导致热量散失,影响测定结果;
(3)盐酸和氢氧化钠混合时,用套在温度计上的环形玻璃搅拌棒轻轻地搅动,使盐酸与NaOH溶液混合均匀;
(4)中和热是一个不变的数值,与酸碱的用量无关;
(5)根据Q=m•c•△T计算反应放出的热量,最后根据△H=-$\frac{Q}{n}$kJ/mol计算出反应热.
解答 解:(1)为了确保盐酸被完全中和,所用NaOH溶液要稍过量,故答案为:确保盐酸被完全中和;
(2)倒入氢氧化钠溶液时,必须一次迅速的倒入,目的是减少热量的散失,不能分几次倒入氢氧化钠溶液,否则会导致热量散失,影响测定结果,故选C;
(3)使盐酸与NaOH溶液混合均匀的正确操作方法是:用套在温度计上的环形玻璃搅拌棒轻轻地搅动;温度计是测量温度的,不能使用温度计搅拌;也不能轻轻地振荡烧杯,否则可能导致液体溅出或热量散失,影响测定结果;更不能打开硬纸片用玻璃棒搅拌,否则会有热量散失,故选D;
(4)中和热是一个不变的数值,与酸碱的用量无关,故答案为:相等;
(5)3次温度差分别为:3.15℃,3.1℃,3.05℃,温度差平均值=3.1℃;50mL 0.25mol/L硫酸与 50mL0.55mol/L NaOH溶液进行中和反应生成水的物质的量为0.05L×0.25mol/L×2=0.025mol,溶液的质量为:100ml×1g/ml=100g,温度变化的值为△T=3.1℃,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×3.1℃=1295.8J,即1.2958KJ,所以实验测得的中和热△H=-$\frac{1.2958kJ}{0.025mol}$=-51.8kJ/mol;
故答案为:-51.8.
点评 本题考查学生中和热测定的实验,保温工作是实验的重点,可以根据所学内容来回答,难度不大.


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:解答题
| 名称 | 性状 | 熔点(℃) | 沸点(℃) | 密度(g/mL) | 溶解性 | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 112.4 (100℃左右升华) | 248 | 1.2659 | 微溶 | 易溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在氧气中燃烧,钠的氧化产物: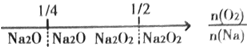 | |
| B. | 铁在Cl2中燃烧,铁的氧化产物: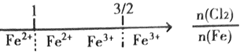 | |
| C. | A1Cl3溶液中滴加NaOH溶液后体系中铝元素的存在形式: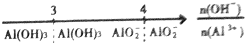 | |
| D. | FeI2溶液中通入Cl2,铁元素存在形式: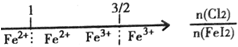 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
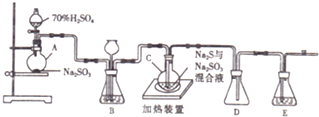
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
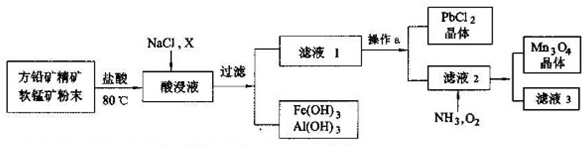
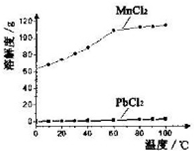
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
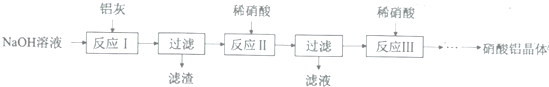
| 氢氧化物 | Fe(OH)3 | Al(OH)3 |
| 开始沉淀pH | 1.9 | 4.2 |
| 沉淀完全pH | 3.2 | 5.4 |
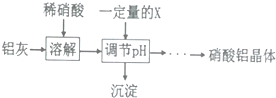
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B<A<D<C<E | B. | E<B<A<D<C | C. | B<A<E<D<C | D. | E<D<C<B<A |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com