
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将一定量的NaNO3和KCl混合加热浓缩至有固体析出,过滤. | 有白色晶体析出 | 白色晶体为KNO3 |
| B | 向2mLNaCl和NaI(浓度均为0.1mol•L-1)混合溶液中滴入2滴0.1mol•L-1AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| C | 向某溶液中加入盐酸酸化的Ba(NO3)2溶液 | 出现白色沉淀 | 该溶液一定有SO42-或 Ag+ |
| D | 向淀粉水解液中加入新制的Cu(OH)2悬浊液,煮沸 | 没有生成(砖)红色沉淀 | 淀粉未水解 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.NaCl的溶解度受温度影响不大,硝酸钾的溶解度受温度影响大;
B.滴入2滴0.1mol•L-1AgNO3溶液,Ksp小的先沉淀;
C.白色沉淀可能为硫酸钡或AgCl;
D.检验水解产物葡萄糖,应在碱性条件下.
解答 解:A.NaCl的溶解度受温度影响不大,硝酸钾的溶解度受温度影响大,应加热浓缩、冷却结晶、过滤分离出KNO3,操作不合理,故A错误;
B.滴入2滴0.1mol•L-1AgNO3溶液,Ksp小的先沉淀,则出现黄色沉淀,可知Ksp(AgCl)>Ksp(AgI),故B正确;
C.白色沉淀可能为硫酸钡或AgCl,则该溶液可能有SO42-或 Ag+,且二者不能同时存在,故C错误;
D.检验水解产物葡萄糖,应在碱性条件下,没有加碱至碱性不能检验葡萄糖,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯、沉淀生成、有机物的检验、离子检验为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:选择题
| A. | X与Y以1:1的原子个数比形成的化合物有多种 | |
| B. | W的最高价氧化物的水化物与Z的最高价氧化物的水化物之间不反应 | |
| C. | 含有元素W的盐溶液既能显酸性,也能显碱性 | |
| D. | 五种元素原子半径:Z>W>M>Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KAl(SO4)2溶液中 c(K+)=2c(SO42-) | |
| B. | 向NaHCO3溶液中加入少量 Ba(OH)2固体,c(CO32-)增大 | |
| C. | 含有AgCl和AgBr固体的悬浊液中,C(Ag+)>c(Cl-)=c(Br-) | |
| D. | 常温下,向含0.1molCH3COOH的溶液中加入amolNaOH固体,反应后溶液中c(CH3COOH)=c(CH3COO-),则溶液显碱性.(已知醋酸Ka=1.75×10-5 ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
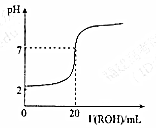 室温时,往20mL 0.1mol•L-1的HM酸溶液中逐滴滴入0.1mol•L-1的ROH碱溶液,溶液的pH与所加的ROH溶液的体积关系如图所示,下列说法正确的是( )
室温时,往20mL 0.1mol•L-1的HM酸溶液中逐滴滴入0.1mol•L-1的ROH碱溶液,溶液的pH与所加的ROH溶液的体积关系如图所示,下列说法正确的是( )| A. | V(ROH)<20mL时,随着V(ROH)增大,HM的电离程度减小 | |
| B. | K(HM)=K(ROH) | |
| C. | RM不能发生水解反应 | |
| D. | V(ROH)>20mL时,溶液中c(R+)<c(M-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
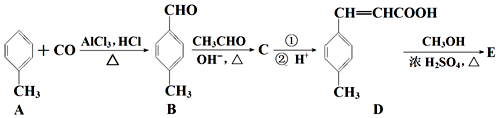
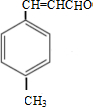 ;D→E的反应类型为酯化反应.
;D→E的反应类型为酯化反应.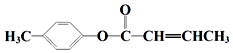 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为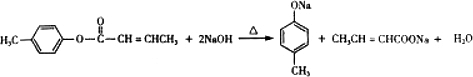 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
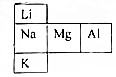 试分析它们的原子结构(电子层数、最外层电子)请指出:
试分析它们的原子结构(电子层数、最外层电子)请指出:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
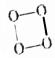 的O4是一种价格超过黄金的气体,下列有关O4的说法中不正确的是( )
的O4是一种价格超过黄金的气体,下列有关O4的说法中不正确的是( )| A. | O4与O3、O2互为同素异形体 | |
| B. | O4与H2反应生成冰 | |
| C. | O4中各原子最外电子层均达到8电子结构 | |
| D. | O4的化学性质一定比O2稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.4g乙烯和丙烯混合气体中含有C-H键的数目为0.2NA | |
| B. | 0.10molFe粉与足量水蒸气反应生成的H2分子数为0.10NA | |
| C. | 标准状况下,11.2LCO2与足量Na2O2反应,转移的电子数为NA | |
| D. | 若将1mol氧化铁完全转化为氢氧化铁胶体,则分散系中胶体粒子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com