
分析 (1)饱和氯化铁在沸水中水解生成胶体;
(2)丁达尔现象为胶体特有的性质;
(3)Fe(OH)3胶体中逐滴滴加稀盐酸,先发生聚沉,后沉淀溶解.
解答 解:(1)甲烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和FeCl3 溶液,继续煮沸直至溶液呈红褐色,停止加热,即可以制得Fe(OH)3胶体.制备Fe(OH)3胶体的化学方程式为FeCl3+3H2O$\frac{\underline{\;△\;}}{\;}$3HCl+Fe(OH)3胶体,
故答案为:饱和;红褐;FeCl3+3H2O$\frac{\underline{\;△\;}}{\;}$3HCl+Fe(OH)3胶体;
(2)甲为胶体分散系,乙为溶液,则分别用激光笔照射烧杯中的液体,可以看到甲烧杯中的液体产生一条光亮的通路,即丁达尔效应.
故答案为:甲;丁达尔效应;
(3)取甲烧杯中的少量Fe(OH)3胶体于试管中,向试管中逐滴滴加稀盐酸,现象为先观察到沉淀,后沉淀溶解,原因为加入的盐酸是电解质,所以先使Fe(OH)3胶体聚沉,后发生酸碱中和反应,沉淀溶解,反应的方程式为Fe(OH)3+3HCl=FeCl3+3H2O,
故答案为:先观察到沉淀,后沉淀溶解;加入的盐酸是电解质,所以先使Fe(OH)3胶体聚沉,后发生酸碱中和反应,沉淀溶解;
点评 本题考查了胶体和溶液、浊液性质的区别,应注意的是在氢氧化铁胶体中加入HCl电解质溶液后,先发生聚沉,后沉淀溶解.


科目:高中化学 来源: 题型:选择题
| A. | 对阳极区溶液呈蓝色的正确解释是:2I--2e-=I2,碘遇淀粉变蓝 | |
| B. | 对阳极区溶液呈蓝色的正确解释是:Cu-2e-=Cu2+,Cu2+显蓝色 | |
| C. | 阴极区溶液呈红色的原因是:2H++2e-=H2↑,使阴极附近OH- 浓度增大,溶液显碱性,从而使酚酞变红 | |
| D. | 阴极上的电极反应式为:Cu2++2e-=Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有碳的氧化物和水 | |
| B. | 只有CO2和水 | |
| C. | 可能有碳的氧化物、水及其他元素的化合物 | |
| D. | 有CO、CO2、水及其他元素的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
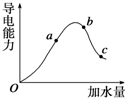 在25℃时,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:
在25℃时,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验内容 | 实验方法 | 实验现象 |
| 验证氧化性 | ||
| 验证不稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 滴定过程中总是存在:Ka>Kh | |
| B. | 点②所示溶液中存在:c(Na+)=c(A-) | |
| C. | 点③所示溶液中存在:c(Na+)=c(A-)+c(HA) | |
| D. | 向点①所示溶液中加水:$\frac{c({A}^{-})}{c(O{H}^{-})•c(HA)}$比值减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2017届山西省高三上期中化学试卷(解析版) 题型:选择题
用如图所示装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U形管的质量差,实验测得m(H)∶m(O)>1∶8。下列对导致这一结果的原因的分析中,一定错误的是
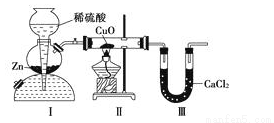
A.Ⅰ、Ⅱ装置之间缺少干燥装置
B.Ⅲ装置后缺少干燥装置
C.Ⅱ 装置中玻璃管内有水冷凝
D.CuO没有全部被还原
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com