
| A. | 工业合成氨 | |
| B. | 雷雨天,空气中的氮气转化为能被植物吸收的硝酸盐 | |
| C. | 用氨气与硝酸制成“硝铵”化肥 | |
| D. | 豆科作物的根瘤菌将空气中的氮转化为氨 |
分析 把大气中的游离态的氮转化为氮的化合物的过程称为固氮,主要有:自然固氮:生物固氮(根瘤菌的固氮)和大气固氮(闪电时N2转化为NO)、工业固氮(合成氨)两大类,据此分析解答.
解答 解:氮的固定是将空气中游离态的氮转化为含氮化合物的过程.
A.工业上合成氨:N2+3H2 2NH3,是由氮气转化为氮的化合物氨,属于工业固氮,故A正确;
2NH3,是由氮气转化为氮的化合物氨,属于工业固氮,故A正确;
B.在雷电作用下,将空气中的氮气转化为含氮化合物硝酸盐,被植物吸收,是由氮气转化为氮的化合物,属于氮的固定,故B正确;
C.由NH3制氮肥,它们间的相互转化,属于化合物间的转化,不符合单质转化为化合物的特点,所以不属于氮的固定,故C错误;
D.大豆的根瘤菌将空气中的氮转化为氨,符合单质转化为化合物的特点,属于氮的固定,故D正确;
故选C.
点评 本题主要考查氮的固定,依据氮的固定是将空气中游离态的氮转化为含氮化合物的过程即可解答,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-═Cl2↑ | |
| B. | 向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$ Fe(OH)3↓+3H+ | |
| C. | 粗铜精炼时,与电源正极相连的是纯铜,正极反应式为:Cu-2e-═Cu2+ | |
| D. | NaHS水解:HS-+H2O?H3O++S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某废金属屑中主要成分为Cu、Fe、Al,还含有少量的铜锈[Cu2(OH)2CO3]、少量的铁锈和少量的氧化铝,用上述废金属屑制取胆矾(CuSO4•5H2O)、无水AlCl3和铁红的过程如图所示:
某废金属屑中主要成分为Cu、Fe、Al,还含有少量的铜锈[Cu2(OH)2CO3]、少量的铁锈和少量的氧化铝,用上述废金属屑制取胆矾(CuSO4•5H2O)、无水AlCl3和铁红的过程如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | >0.1mol/L | B. | <0.1mol/L | C. | 0.1mol/L | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Ca2+>Cl->S2- | B. | 第一电离能:Si>C>N | ||
| C. | 电负性:F>S>Mg | D. | 热稳定性:SiH4>H2S>H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Na>Si>Cl | B. | 还原性:Na>Mg>Al | ||
| C. | 稳定性:SiH4>H2S>HCl | D. | 酸性:H3PO4<H2SO4<HClO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
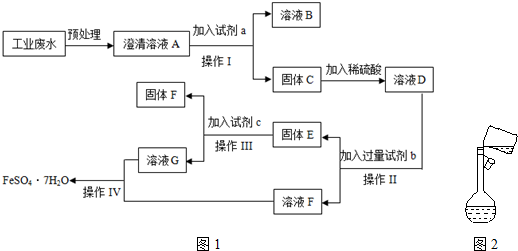
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com