
【题目】25℃时,取浓度均为0.1000molL-1的醋酸溶液和氨水溶液各20.00mL,分别用0.1000molL-1NaOH溶液、0.1000molL-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法不正确的是( )
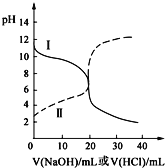
A. 根据滴定曲线可得,25℃时 Ka(CH3COOH)≈Kb(NH3H2O)≈10-5
B. 当NaOH溶液和盐酸滴加至20.00mL时,曲线Ⅰ和Ⅱ刚好相交
C. 曲线I表示的滴定过程一般选择甲基橙作指示剂
D. 在逐滴加入NaOH溶液或盐酸至40.00mL的过程中,水的电离程度先增大后减小
【答案】B
【解析】
I曲线开始点为碱性,说明用盐酸滴定氨水,Ⅱ曲线为NaOH滴定醋酸溶液,然后逐步分析;
A、I曲线的起点为碱性,说明用盐酸滴定氨水,开始时氨水的pH约为11,即溶液中c(OH-)=10-3mol·L-1,则氨水的电离平衡常数Kb=![]() 1×10-5,Ⅱ曲线的起点为酸性,用氢氧化钠滴定醋酸,开始时醋酸的pH约为3,同理得到Ka=1×10-5,故A说法正确;
1×10-5,Ⅱ曲线的起点为酸性,用氢氧化钠滴定醋酸,开始时醋酸的pH约为3,同理得到Ka=1×10-5,故A说法正确;
B、当NaOH溶液和盐酸滴加至20mL,氢氧化钠与醋酸反应生成CH3COONa,溶液显碱性,溶液的pH>7;盐酸与氨水反应生成氯化铵,溶液显酸性,溶液的pH<7,因此曲线I和Ⅱ一定不会相交,故B说法错误;
C、根据选项B的分析,滴定到终点时,溶液显酸性,因此选用甲基橙为指示剂,故C说法正确;
D、酸和碱对水的电离起到抑制作用,在逐滴加入NaOH或盐酸过程中,溶液的碱性或酸性逐步降低,水的电离程度逐渐增大,当恰好完全反应时,水的电离程度达到最大,之后继续滴入NaOH或盐酸,溶液的碱性或酸性逐渐增强,水的电离程度逐渐减小,故D说法正确;
答案选B。


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质中分子数相同的是( )
A.2 L CO和2 L CO2B.9 g H2O和标准状况下11.2 L CO2
C.标准状况下1 mol O2和22.4 L H2OD.0.2 mol NH3和4.48 L HCl气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 次氯酸的电离方程式为HClO===H++ClO-
B. pH=7的溶液一定是中性溶液
C. 在CH3COONa溶液中,c(CH3COO-)<c(Na+)
D. 0.2 mol·L-1CH3COOH溶液中的c(H+)是0.1 mol·L-1 HCl溶液中的c(H+)的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20mL某物质的量浓度的AlCl3溶液中滴加2mol/LNaOH溶液时,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH溶液的体积(mL)和所得沉淀的物质的量(mol)的关系如图所示。则:

(1)写出OA段发生反应的离子方程式:OA段___,图中线段OP:PB=__,
(2)计算原AlCl3溶液的物质的量浓度为__mol/L,
(3)图中A对应的横坐标为__mL,
(4)当加入5mLNaOH溶液时,产生沉淀量为__mol,
(5)当加入的NaOH溶液过量时,使最初生成的沉淀部分溶解,要得到与(4)中相同的沉淀量,加入NaOH溶液的体积为__mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)现有反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0。在850℃时,K=1。
CH3OH(g)+H2O(g) ΔH<0。在850℃时,K=1。
①如果上述反应的平衡常数K值变大,该反应___(填字母)。
a.一定向正反应方向移动 b.在平衡移动过程中正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动过程中逆反应速率先减小后增大
②若反应容器的容积为2.0L,反应时间4.0min,容器内气体的物质的量减小了0.8mol,在这段时间内CO2的平均反应速率为___。
③在850℃时,若向1L的密闭容器中同时充入3.0mol CO2、1.0molH2、1.0molCH3OH、5.0molH2O(g),上述反应向___(填“正反应”或“逆反应”)方向进行。
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是___。
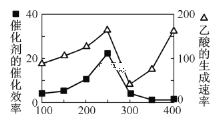
②为了提高该反应中CO2的转化率,可以采取的措施是___。(写一条即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种医药中间体,其结构简式如图所示。下列有关化合物X的说法正确的是( )

A.分子中的所有碳原子可能处于同一平面
B.在酸性条件下的水解产物能与FeCl3显色
C.不能与NaHCO3溶液反应
D.1mol化合物X最多能与2mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH4= -1048.9kJ·mol-1
(1)上述反应热效应之间的关系式为ΔH4=______。
(2)联氨分子的电子式_____,联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为______(已知:N2H4+H+ ![]() N2H5+的K=8.7×107;Kw=1.0×10-14)
N2H5+的K=8.7×107;Kw=1.0×10-14)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是组成人体细胞的主要元素及其比例:下列相关叙述中,错误的是( )

A.组成人体细胞的主要元素是碳、氢、氧、氮、磷等
B.在人体细胞中含量最多的元素是氧
C.构成人体细胞的最基本元素是碳
D.其他元素含量小于3%,所以作用也很小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是

A. 原子半径:W<X
B. 常温常压下,Y单质为固态
C. 气态氢化物热稳定性:Z<W
D. X的最高价氧化物的水化物是强碱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com