

分析 A、B、C、D、E、F六种短周期主族元素,原子序数依次增大,1.8gE与足量盐酸反应生成ECl3和2.24L氢气(标况),故E为+3价元素,设E的相对原子质量为M,则$\frac{2.24L}{22.4L/mol}$×2=$\frac{1.8g}{Mg/mol}$×3,解得M=27,故E为Al,工业上用电解氧化铝方法冶炼铝单质,所以B为氧元素,B、F同主族,则F是硫,A、B、F三者原子序数之和为25,则A是氢,且D+离子和Al离子具有相同的电子结构,故D为钠,C的原子序数大于氧、小于钠,且为主族元素,故C为氟.
解答 解:A、B、C、D、E、F六种短周期主族元素,原子序数依次增大,1.8gE与足量盐酸反应生成ECl3和2.24L氢气(标况),故E为+3价元素,设E的相对原子质量为M,则$\frac{2.24L}{22.4L/mol}$×2=$\frac{1.8g}{Mg/mol}$×3,解得M=27,故E为Al,工业上用电解氧化铝方法冶炼铝单质,所以B为氧元素,B、F同主族,则F是硫,A、B、F三者原子序数之和为25,则A是氢,且D+离子和Al离子具有相同的电子结构,故D为钠,C的原子序数大于氧、小于钠,且为主族元素,故C为氟.
(1)同周期元素自左而右非金属性逐渐增强,同主族元素从上向下非金属性逐渐减弱,所以六种元素中非金属性最强的是氟,位于周期表中第二周期第ⅤⅡA族,故答案为:C;第二周期第ⅤⅡA族;
(2)由A、B、D三种元素形成化合物为NaOH,它的电子式是 ,故答案为:
,故答案为: ;
;
(3)a.氧元素没有最高价氧化物对应水化物,故a错误;
b.元素非金属性与气态氢化物的热稳定性一致,元素的非金属性越强,氢化物稳定性越强,故b正确;
c.气态氢化物的沸点与分子间作用力有关,与元素的非金属性无关,故c错误;
d.向硫的气态氢化物溶液中通入氧气,有浑浊,说明氧气的氧化性强于硫,即氧的非金属性强于硫,故d正确,
故选:bd;
(4)①由A、B、D、F四种元素可以组成两种酸式盐为NaHSO3、NaHSO4,这两种盐相反应的离子方程式为:HSO3-+H+=SO2↑+H2O,故答案为:HSO3-+H+=SO2↑+H2O;
②D的最高价氧化物对应水化物为NaOH,足量的NaOH与AlCl3相互反应的离子方程式:4OH-+Al3+=AlO2-+2H2O,故答案为:4OH-+Al3+=AlO2-+2H2O.
点评 本题考查原子结构与元素周期律,元素的推断是解答本题的关键,熟悉掌握元素化合物性质,掌握金属性、非金属性强弱比较实验事实.


科目:高中化学 来源: 题型:选择题
| A. | P4和CH4分子的立体构型都是正四面体形且键角都为109°28' | |
| B. | NaCl晶体中与每个Na+距离相等且最近的Na+共有6个 | |
| C. | 单质的晶体中一定不存在阴离子 | |
| D. | SO2、BF3、NC13分子中所有原子的最外层电子均未达到8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
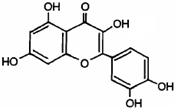
| A. | 在浓硫酸加热下,槲皮素可发生消去反应 | |
| B. | 槲皮素分子中不含手性碳原子 | |
| C. | 槲皮素的苯溶液加入浓溴水产生白色沉淀 | |
| D. | 1mol槲皮素最多可与5molNaOH发生中和反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
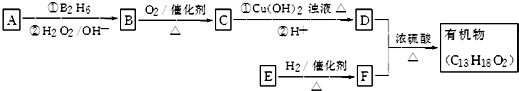
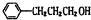 .
.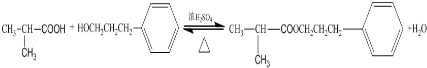 ;其反应类型是取代反应.
;其反应类型是取代反应.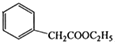 )是一种重要的医药中间体.写出以苯乙酮(
)是一种重要的医药中间体.写出以苯乙酮(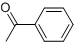 )和乙醇为主要原料制备苯乙酸乙酯的合成路线流程图(无机试剂任选).
)和乙醇为主要原料制备苯乙酸乙酯的合成路线流程图(无机试剂任选).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 按如图所示,两个烧杯中分别盛有足量的稀硫酸溶液和氯化铜溶液:
按如图所示,两个烧杯中分别盛有足量的稀硫酸溶液和氯化铜溶液:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
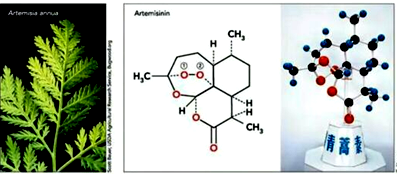
| A. | 青蒿素极易溶于水 | |
| B. | 1 mol青蒿素与足量NaOH溶液反应最多消耗4 mol NaOH | |
| C. | 青蒿素含有过氧键,有较强氧化性 | |
| D. | 青蒿素分子式为C15H21O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
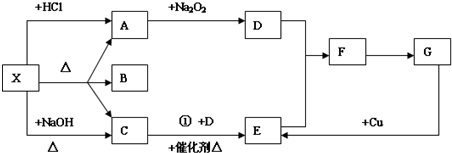
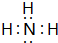
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为产物内部的能量 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 每消耗0.1molNH4HCO3放出2.24L CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com