
| A、锅炉水垢中的硫酸钙可用碳酸钠溶液处理,使之转化为碳酸钙,再用酸除去 |
| B、日本福岛核电站爆炸时释放的两种放射性核素13153I与13755Cs的中子数相等 |
| C、铝合金的大量使用归功于人们能使用焦炭等还原剂从氧化铝中获得铝 |
| D、海水淡化可以解决淡水供应危机,向海水中加入明矾可以使海水淡化 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
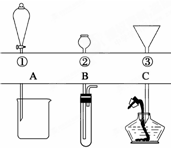 如图所示,①~③是几种漏斗的上部,A、B、C是实际操作(分液、制气、向容器中加液体试剂等)时,各种漏斗的下部插入容器中的示意图.请根据实际操作时上述漏斗的使用范围和它们的形状,指出A~C分别与①~③中哪一种最匹配(图中漏斗及容器中的药品和其他物品均已略去,铁架台、铁夹也已略去).A与
如图所示,①~③是几种漏斗的上部,A、B、C是实际操作(分液、制气、向容器中加液体试剂等)时,各种漏斗的下部插入容器中的示意图.请根据实际操作时上述漏斗的使用范围和它们的形状,指出A~C分别与①~③中哪一种最匹配(图中漏斗及容器中的药品和其他物品均已略去,铁架台、铁夹也已略去).A与查看答案和解析>>
科目:高中化学 来源: 题型:
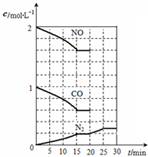 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.| 催化剂 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:
| A、PbCrO4先沉淀 |
| B、PbSO4先沉淀 |
| C、PbCrO4和PbSO4一起沉淀 |
| D、PbCrO4和PbSO4都不沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ?mol-1低温可自发进行 |
| B、常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下Ksp(BaCO3)<Ksp(BaSO4) |
| C、室温时,0.1mol/L某一元酸在水中有0.1%电离,此酸的电离平衡常数约为1×10-7 |
| D、将镁条和铝片用导线连接再插进稀NaOH溶液,镁条上产生气泡,说明铝比镁活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgCl沉淀生成和沉淀溶解不断进行,但速率为0 |
| B、AgCl难溶于水,溶液中没有Ag+和Cl- |
| C、升高温度,AgCl沉淀的溶解度增大 |
| D、向AgCl沉淀中加入NaCl固体,AgCl沉淀的溶解度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com