
分析 (1)据n=$\frac{m}{M}$计算;
(2)根据每个分子中含有的原子数计算总原子数;
(3)根据V=nVm计算;
(4)分子数相等也就是物质的量相等;
(5)两者的原子数相等,也就是5R~~2CH4.
解答 解:(1)m g某气体的物质的量为$\frac{mg}{Mg/mol}$=$\frac{m}{M}$mol,故答案为:$\frac{m}{M}$;
(2)因为一个分子中含两个原子,所以含有的原子数为分子数的2倍,即为2×$\frac{m}{M}$ mol×NAmol-1=$\frac{2m{N}_{A}}{M}$,故答案为:$\frac{2m{N}_{A}}{M}$;
(3)该体积的体积为$\frac{m}{M}$ mol×22.4L/mol=$\frac{22.4m}{M}$L,故答案为:$\frac{22.4m}{M}$;
(4)分子数相等也就是物质的量相等,所以m=nM=$\frac{m}{M}$×28=$\frac{28m}{M}$,故答案为:$\frac{28m}{M}$;
(5)设气体为R,两者的原子数相等,也就是5R~~2CH4,
5 2
$\frac{m}{M}$ $\frac{2m}{5M}$
故答案为:$\frac{2m}{5M}$.
点评 本题考查常用化学计量的计算等,难度不大,注意对公式的理解与灵活运用.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:选择题
| A. | 该反应的平衡常数表达式:K=$\frac{{c}^{4}({H}_{2}O)}{{c}^{4}({H}_{2})}$ | |
| B. | 若容器内气体的压强保持不变,说明该反应已达到平衡状态 | |
| C. | 若Fe3O4足量,改变起始充入H2的浓度,达平衡时H2的转化率不变 | |
| D. | 经2min后,H2浓度下降了0.1mol.L-1则反应速度为v(H2O)=0.05mol.L-1.min-1. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
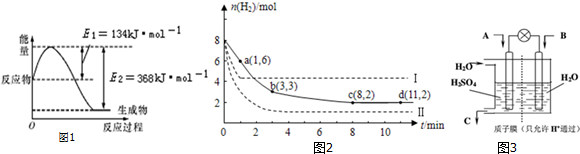
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的相对原子质量呈周期性变化 | |
| B. | 元素的原子半径呈周期性变化 | |
| C. | 元素的金属性和非金属性呈周期性变化 | |
| D. | 元素原子的核外电子排布呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
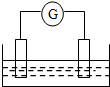 如图是常见原电池装置,电流表G发生偏转:
如图是常见原电池装置,电流表G发生偏转:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com