
| A. | ①④③ | B. | ⑤④③ | C. | ②①③ | D. | ②①④ |
分析 用丙醇制取1,2一丙二醇,官能团数目变化,1,2一丙二醇有2个羟基,且处于相邻的碳原子上,所以应先制备丙烯,再与溴加成,制得1,2一二溴丙烷,再在碱的水溶液条件下水解,得1,2一丙二醇;
要制备丙烯,先在浓硫酸加热条件下发生消去反应,得丙烯.据此分析.
解答 解:用丙醇制取1,2一丙二醇,官能团数目变化,1,2一丙二醇有2个羟基,且处于相邻的碳原子上,所以应先制备丙烯,即丙醇先在浓硫酸做催化剂、加热的条件下发生消去反应得丙烯,再与溴加成,制得1,2一二溴丙烷,再在碱的水溶液条件下水解,即得1,2一丙二醇.
故合成路线依次发生的反应所属类型顺序为①④③,
故选A.
点评 本题考查有机物的合成、反应类型等,难度中等,关键根据原料与目标物结构,采用逆推法设计合理的合成路线.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将一束强光通过淀粉溶液,也能产生丁达尔效应 | |
| B. | 在溶有1 mol Fe(OH)3的胶体中,约含6.02×1023个Fe(OH)3胶粒 | |
| C. | 一枝钢笔使用两种不同型号的蓝黑墨水,易出现堵塞 | |
| D. | “雨后彩虹”“海市蜃楼”既是一种自然现象又是光学现象,也与胶体的性质有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 装置图 | 所盛试剂 | 实验现象 | |
| 1 | 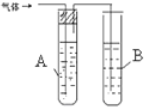 | A是 水 B是 酸性高锰酸钾溶液 | |
| 2 |  | C是 溴的四氯化碳溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述四种氧化物中,只有SiO2是酸性氧化物,它不溶于任何酸 | |
| B. | 向沉淀X中逐滴加入硝酸,沉淀慢慢溶解 | |
| C. | 溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+ | |
| D. | 溶液Y中加入过量氨水,所得沉淀为Fe(OH)3和Mg(OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com