
【题目】Ⅰ、在下列转化关系中,烃A为石油的裂解气里含量较高的气体(碳元素的质量分数为0.857),B分子中含有三元环,分子式为C2H4O;1molD与足量Zn反应生成22.4LH2(标准状况);E为六元环化合物。请回答下列问题:
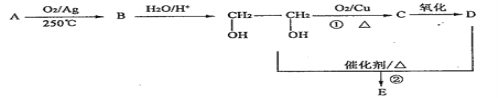
(1)A 的结构简式____________。
(2)①的反应类型为___________。
(3)D中官能团的名称是____________。
(4)写出反应②的化学方程式___________。
Ⅱ、化合物W可用作高分子膨胀剂,一种合成路线如下:
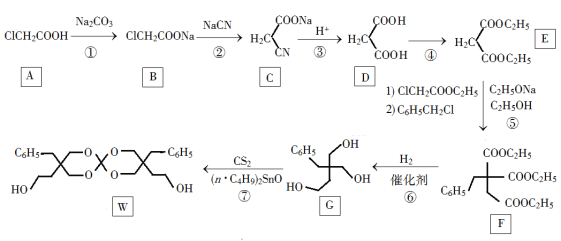
(1)A的化学名称为________。
(2)②的反应类型是__________。
(3)G的分子式为________。
(4)写出与E互为同分异构体的酯类化合物的结构简式(核磁共振氢谱为两组峰,峰面积比为1∶1)______________。(写出一种即可)
【答案】 CH2=CH2 氧化反应 羧基  氯乙酸 取代反应 C12H18O3
氯乙酸 取代反应 C12H18O3  、
、
【解析】Ⅰ、烃A为石油的裂解气里含是较高的气体(碳元素的质量分数为0.857),则A为CH2=CH2,结合图中转化可知,A发生氧化反应生成B分子中含有三元环,分子式为C2H4O,B为环氧乙烷;B与水发生加成反应生成乙二醇,乙二醇氧化生成C为OHCCHO,C氧化生成D,1molD与足量Zn反应生成22.4LH2(标准状况),D中含2个-COOH,D为HOOC-COOH;E为六元环化合物,乙二醇与乙二酸发生中和酯化反应生成E,E为 ,以此来解答;Ⅱ、A是氯乙酸与碳酸钠反应生成氯乙酸钠,氯乙酸钠与NaCN发生取代反应生成C,C水解又引入1个羧基。D与乙醇发生酯化反应生成E,E发生取代反应生成F,在催化剂作用下F与氢气发生加成反应将酯基均转化为醇羟基,2分子G发生羟基的脱水反应成环,据此解答。
,以此来解答;Ⅱ、A是氯乙酸与碳酸钠反应生成氯乙酸钠,氯乙酸钠与NaCN发生取代反应生成C,C水解又引入1个羧基。D与乙醇发生酯化反应生成E,E发生取代反应生成F,在催化剂作用下F与氢气发生加成反应将酯基均转化为醇羟基,2分子G发生羟基的脱水反应成环,据此解答。
Ⅰ、(1)A为乙烯,其的结构简式CH2=CH2;
(2)①中-OH转化为-CHO,其反应类型为氧化反应;
(3)D物质乙二酸,含氧原子团的名称为羧基,HOCH2CH2OH与金属钠反应的化学方程式为HOCH2CH2OH+2Na→Na OCH2CH2O Na+H2↑;(4)反应②的化学方程式为 ;
;
Ⅱ、(1)根据A的结构简式可知A是氯乙酸;(2)反应②中氯原子被-CN取代,属于取代反应;(3)根据G的键线式可知其分子式为C12H18O3;(4)属于酯类,说明含有酯基。核磁共振氢谱为两组峰,峰面积比为1:1,说明氢原子分为两类,各是6个氢原子,因此符合条件的有机物结构简式为 或
或 。
。


科目:高中化学 来源: 题型:
【题目】研究者设计利用芳香族化合物的特殊性质合成某药物,其合成路线如下(部分反应试剂和条件已省略):
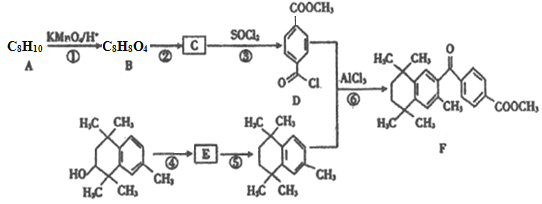
已知:I. 
Ⅱ. ![]()
回答下列问题:
(1)B的名称是______________。
(2)反应⑤所属的反应类型为______________。
(3)反应⑥的化学方程式为___________________________。
(4)芳香族化合物X是C的同分异构体,只含一种官能团且1molX与足量 NaHCO3溶液发生反应生成2 molCO2,则X的结构有_______种。其中核磁共振氢谱显示有4组峰,且峰面积之比为3:2:2:1的结构简式为______________。
(5)写出以乙醇和甲苯为原料制备 的路线(其他无机试剂任选)___________________。
的路线(其他无机试剂任选)___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将可能混有NaOH的16.80gNaHCO3固体,在200℃条件下充分加热,排出反应产生的气体,得到固体的质量为bg。
(1)b的最小值为___________。
(2)当b=____________时,产物中水的质量最多。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
相对分子质量 | 密度/(gcm-3) | 沸点/℃ | 水中溶解性 | |
异戊醇 | 88 | 0.8123 | 131 | 微溶 |
乙酸 | 60 | 1.0492 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
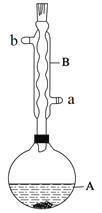
实验步骤:
在A中加入4.4 g异戊醇(3-甲基-1-丁醇)、6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50 min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9 g。
回答下列问题:
(1)仪器B的具体名称是____________,实验时冷却水的进水口是_____(a或b)。
(2)在洗涤操作中,先水洗再饱和NaHCO3溶液洗而不是直接用饱和NaHCO3溶液洗涤的原因是____________________。
(3)该制备反应的化学反应方程式为__________________________。
(4)本实验中加入过量乙酸的目的是___________________________。
(5)本实验中不能用生石灰代替无水MgSO4的原因________________________。
(6)在蒸馏操作中,仪器选择及安装都正确的是___________(填标号)。
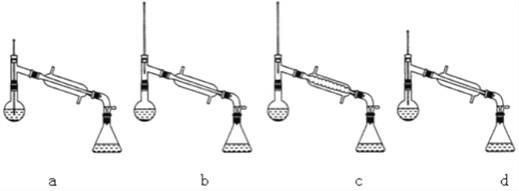
(7)本实验的产率是___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列说法正确的是( )
A. 常温常压下,64g SO2中含有的原子数为3NA
B. 标准状况下,11.2L CCl4所含原子数目为2.5NA
C. 2L 0.1 molL﹣1K2SO4溶液中含K+物质的量为0.2 mol
D. 1.0 mol CH4与Cl2在光照下反应生成的CH3Cl分子数为1.0NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100 mL甲气体经过如图所示实验的处理,结果得到酸性溶液,而几乎无气体剩余,下列说法正确的是( )

A. 甲气体肯定有NO2
B. 经过浓硫酸处理后余气中NO、CO2体积比为2:3
C. 甲气体的组成可能为NH3、NO、NO2
D. 经过Na2O2处理后剩余气体体积大于80mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图是旺旺同学设计的一个简易的原电池装置,请回答下列问题。

(1)若 a电极材料为碳、b溶液为 FeCl3溶液,则正极的电极反应式为____,当有1.6g负极材料溶解时,转移的电子为____mol;
(2)若 a 电极材料为铁、b溶液为浓硝酸,电流表的指针也会偏转,则电子的流向为______→ __________(填电极材料,下同),溶液中的NO3-向________极移动;
(3)氢氧燃料电池已用于航天飞机。这种电池以30%KOH溶液为电解质溶液,供电时总反应为:2H2+O2=2H2O,则正极的电极方程式为________________。
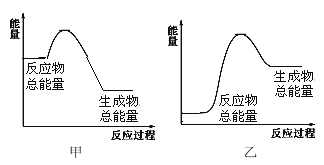
Ⅱ.已知H-H 键、N-H 键、N≡N 键的键能分别为 436kJ/mol、391kJ/mol、946 kJ/mol,关于工业合成氨的反应,请根据键能的数据判断下列问题:
(4)若有 1 mol NH3生成 ,可________(填“吸收”或“放出”)热量________kJ;该反应的能量变化可用图__________表示。(填“甲“或“乙”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型无机非金属材料。某AlN样品仅含有Al2O3杂质,为测定AlN的含量,设计如下两种实验方案。已知:AlN+NaOH+H2O═NaAlO2+NH3↑
(方案 1)取一定量mg 的样品,用图1装置测定样品中AlN的纯度(夹持装置已略去)。
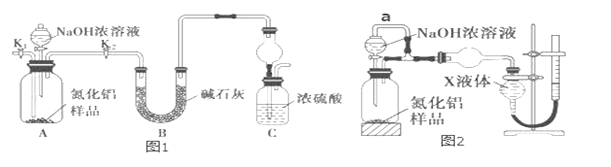
(1)如图 1,C 装置中球形干燥管的作用是_____。
(2)完成以下实验步骤:组装好实验装置,首先检查装置气密性,再加入实验药品。接下来的实验操作是______________ ,打开分液漏斗活塞,加入 NaOH 浓溶液,至不再产生气体。打开 K1,通入氮气一段时间,测定 C 装置反应前后的质量变化。通入氮气的目的是___________。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见_____。
(方案 2)用图 2 装置测定 mg 样品中 AlN 的纯度(部分夹持装置已略去)。
(4)为测定生成气体的体积,量气装置中的X液体可以是_____。(填字母序号)
a.CCl4 b.H2O c.NH4Cl 溶液 d.C6H6(苯)
(5)若 mg 样品完全反应,测得生成气体的体积为 VmL(已转换为标准状况),则 AlN 的质量分数是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com