
【题目】下列实验的现象与结论相对应的是
A | B | C | D | |
实验 |
|
|
|
|
现象 | 电流计指针向右偏(电子由Fe转移到Cu),片刻后向左偏 | 加热一段时间后溶液蓝色褪去 | 加热,肥皂液中产生无色气泡 | ①和②中均迅速产生大量气泡 |
结论 | 铁片作负极,片刻后铜片作负极 | 淀粉在酸性条件下水解,产物是葡萄糖 | 铁粉与水蒸气反应生成H2 | MnO2一定是②中反应的催化剂 |
A.AB.BC.CD.D
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】下列溶液中的离子一定能大量共存的是( )
A.含大量H+的溶液中:Na+、K+、SO42-、HCO3-
B.在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3-
C.能使酚酞变红的溶液中:Na+、NO3-、K+、AlO2-
D.含大量Fe3+的溶液中:NH4+、Na+、I-、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是一种有效的抗疟药。常温下,青蒿素为无色针状晶体,难溶于水,易溶于有机溶剂,熔点为156~157℃。提取青蒿素的方法之一是乙醚浸取法,提取流程如下:
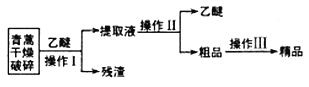
请回答下列问题:
(l)对青蒿进行破碎的目的是__________________。
(2)操作I用到的玻璃仪器是__________,操作Ⅱ的名称是_______。
(3)用下列实验装置测定青蒿素的化学式,将28.2g青蒿素放在燃烧管C中充分燃烧:
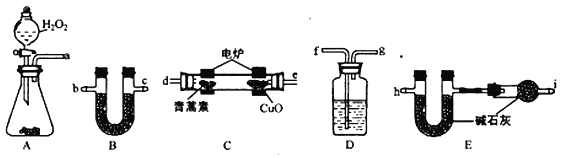
① 仪器各接口的连接顺序从左到右依次为_______(每个装置限用一次)。A装置中发生的化学反应方程式为_________________。
② 装置C中CuO的作用是_________________。
③ 装置D中的试剂为_________________。
④ 已知青蒿素是烃的含氧衍生物,用合理连接后的装置进行实验.测量数据如下表:
装置质量 | 实验前/g | 实验后/g |
B | 22.6 | 42.4 |
E(不含干燥管) | 80.2 | 146.2 |
则青蒿素的最简式为__________。
(4)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH 、酚酞的水溶液中,青蒿素的溶解度较小,加热并搅拌,青蒿素的溶解度增大,且溶液红色变浅,与青蒿素化学性质相似的物质是______(填字母代号)。
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,将6molCO2和8molH2充入2L密闭容器中,发生反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示,图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化,下列说法正确的是( )
CH3OH(g)+H2O(g),容器中H2的物质的量随时间变化如图中实线所示,图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化,下列说法正确的是( )
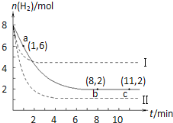
A.曲线Ⅱ对应的条件改变是降低压强
B.若曲线Ⅰ对应的条件改变是升温,则该反应△H>0
C.反应开始至a点时v(H2)=1mol·L-1·min-1
D.T℃时,该反应的化学平衡常数为0.125
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在接触法制硫酸和合成氨工业的生产过程中,下列说法错误的是()
A.硫铁矿在燃烧前要粉碎,目的是使硫铁矿充分燃烧,加快反应速率
B.二氧化硫的催化氧化反应的温度控制在450度左右,主要考虑到催化剂V2O5的活性温度
C.吸收塔中用98.3%的浓硫酸代替水吸收SO3,以提高效率
D.工业上为提高反应物N2、H2的转化率和NH3的产量和反应速率,常在合成氨反应达到平衡后再分离氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体锌电池是一种电压较高的二次电池,具有成本低、安全性强、可循环使用等特点,其示意图如右图。下列说法不正确的是
已知:①Zn(OH)2+2OH == Zn(OH)42 。 ②KOH凝胶中允许离子存在、生成或迁移。
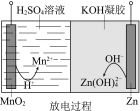
A.放电过程中,H+由正极向负极迁移
B.放电过程中,正极的电极反应:MnO2+4H++2e== Mn2++2H2O
C.充电过程中,阴极的电极反应:Zn(OH)42+2e == Zn+4OH
D.充电过程中,凝胶中的KOH可再生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )

A.图中a和b分别为T1、T2温度下CdS在水中的溶解度
B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)
C.向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动
D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究铁在某浓度H3PO4和H2O2的混合溶液中反应的情况,进行如下实验:
实验 | 操作 | 现象 |
Ⅰ | 将除去氧化膜的铁钉置于烧杯中,加入30 mL 1.0 mol·L1 H3PO4和 3 mL 30% H2O2的混合溶液(pH≈1)。 | 一段时间后铁钉表面突然产生大量气泡,随后停止产生气泡;一段时间后再产生大量气泡,再停止,出现周而往复的现象。过程中,溶液保持澄清。
|
Ⅱ | 将与实验Ⅰ相同的铁钉放入烧杯中,加入30 mL 1.0 mol·L1H3PO4和3 mL H2O。 | 片刻后铁钉表面持续产生气泡,溶液保持澄清。 |
已知:Fe3(PO4)2难溶于水,Fe(H2PO4)2溶于水。
(1)用85% H3PO4配制100 mL 1.0 mol·L1H3PO4所用的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管、______。
(2)实验Ⅱ中铁钉表面产生气体的化学方程式是______。
(3)探究停止产生气泡的原因。
提出假设:铁钉表面形成了含有+3价铁的氧化膜将铁钉覆盖。
甲同学进行实验Ⅲ,得出假设成立的结论。
实验Ⅲ:将洗净的实验Ⅰ中无气泡产生时的铁钉置于试管中,加入滴有KSCN溶液的稀H2SO4,振荡,静置,溶液呈红色。
乙同学认为实验Ⅲ无法证实假设成立,其理由是_____。
乙同学通过改进实验证实了假设成立。
(4)铁钉表面突然产生大量气泡的可能原因是Fe2+迅速被H2O2氧化形成氧化膜,使聚集在铁钉表面的H2脱离铁钉表面。
①实验Ⅳ证实了形成氧化膜过程中产生H+。
实验Ⅳ:______(填操作),滴入少量FeSO4溶液后,立即测定pH,pH迅速降低。
②形成氧化膜(以Fe2O3计)的离子方程式是______。
(5)实验Ⅰ中周而往复的现象与铁钉表面氧化膜的生成和溶解密切相关,从反应的速率
角度分析其原因:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:将Cl2通入适量NaOH溶液,产物中可能有NaCl、NaClO、NaClO3,且![]() 的值仅与温度高低有关,当n(NaOH)=6a mol时,下列有关说法正确的是
的值仅与温度高低有关,当n(NaOH)=6a mol时,下列有关说法正确的是
A. 改变温度,反应中转移电子的物质的量n的范围:3a mol≤n≤5a mol
B. 改变温度,产物中NaCl的最小理论产量为4a mol
C. 参加反应的氯气的物质的量为6a mol
D. 某温度下,若反应后![]() =6,则溶液中
=6,则溶液中![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com