
【题目】PbO2及2PbCO3Pb(OH)2(碱式碳酸铅)均是生产铅酸蓄电池正极的原料.
(1)PbO2可由NaClO氧化Pb(NO3)2溶液得到.
①Pb(NO3)2被氧化为PbO2的离子方程式为 .
②Pb(NO3)2溶液中通入H2S发生Pb2+(aq)+H2S(aq)PbS(s)+2H+(aq),直至平衡,该反应的平衡常数为K=1已知:Ksp(PbS)=3.55×10﹣28;H2S电离常数Ka1=1.3×10﹣7 , Ka2=7.1×10﹣15].
(2)制备碱式碳酸铅的实验步骤如图1: 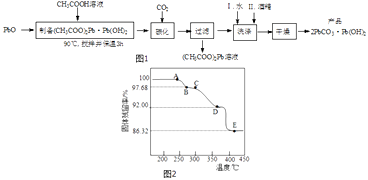
①“碳化”时,发生反应的化学方程式为 .
②“洗涤”时,经水洗涤后再用酒精洗涤的目的是 .
(3)为确定2PbCO3Pb(OH)2(相对式量:775)的热分解过程,进行如下实验:称取一定量(2)实验制得的样品放在热重分析仪中,在氩气流中热分解,测得样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如图2所示.
①A→B过程中,从体系中逸出的分解产物(化合物)为(填化学式);C→D过程中,从体系中逸出的分解产物(化合物)为(填化学式).
②根据图中实验数据,计算并确定E点残留固体的化学式(写出计算过程).
【答案】
(1)Pb2++ClO﹣+H2O=PbO2↓+Cl﹣+2H+;2.6×106
(2)3[(CH3COO)2Pb?Pb(OH)2]+2CO2=3(CH3COO)2Pb+2PbCO3?Pb(OH)2↓+2H2O;除去沉淀表面附着的水并促进其快速干燥
(3)H2O;CO2
【解析】解:(1)①Pb(NO3)2被NaClO氧化为PbO2 , NaClO被还原成氯离子,反应的离子方程式为Pb2++ClO﹣+H2O=PbO2↓+Cl﹣+2H+ ,
所以答案是:Pb2++ClO﹣+H2O=PbO2↓+Cl﹣+2H+;
②根据反应Pb2+(aq)+H2S(aq)PbS(s)+2H+(aq),平衡常数K= ![]() =
= ![]() =2.6×106 ,
=2.6×106 ,
所以答案是:2.6×106;(2)①“碳化”时,用CH3COO)2PbPb(OH)2与二氧化碳反应生成2PbCO3Pb(OH)2 , 发生反应的化学方程式为 3[(CH3COO)2PbPb(OH)2]+2CO2=3(CH3COO)2Pb+2PbCO3Pb(OH)2↓+2H2O,
所以答案是:3[(CH3COO)2PbPb(OH)2]+2CO2=3(CH3COO)2Pb+2PbCO3Pb(OH)2↓+2H2O;②“洗涤”时,经水洗涤后再用酒精洗涤的目的是除去表面的水份同时可以快速干燥,得纯净2PbCO3Pb(OH)2的产品,
所以答案是:除去沉淀表面附着的水并促进其快速干燥;(3)①根据图可知加热后得固体的质量分数,结合2PbCO3Pb(OH)2的相对式量:775,所以1mol2PbCO3Pb(OH)2的质量为775g,A→B过程中, ![]() =1﹣0.9768,所以△m1=18g,减少的是H2O;C→D过程中,
=1﹣0.9768,所以△m1=18g,减少的是H2O;C→D过程中, ![]() =0.9768﹣0.9200,所以△m2=44g,减少的是CO2 ,
=0.9768﹣0.9200,所以△m2=44g,减少的是CO2 ,
所以答案是:H2O;CO2;②1mol2PbCO3Pb(OH)2的质量为775g,A→B过程中, ![]() =1﹣0.9768,所以△m1=18g,减少的是H2O;C→D过程中,
=1﹣0.9768,所以△m1=18g,减少的是H2O;C→D过程中, ![]() =0.9768﹣0.9200,所以△m2=44g,减少的是CO2;D→E过程中,
=0.9768﹣0.9200,所以△m2=44g,减少的是CO2;D→E过程中, ![]() =0.9200﹣0.8632,△m3=44g,减少的是CO2 , 2PbCO3Pb(OH)2共脱去1个H2O及2个CO2 , 故E点残留固体为PbO,
=0.9200﹣0.8632,△m3=44g,减少的是CO2 , 2PbCO3Pb(OH)2共脱去1个H2O及2个CO2 , 故E点残留固体为PbO,
答:E点残留固体的化学式为PbO.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中、受热时均易分解.实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2 , 实验装置如图所示. 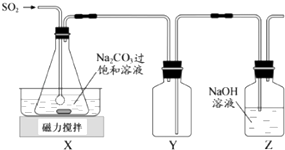
当溶液pH约为4时,停止反应.在20℃左右静置结晶.生成Na2S2O5的化学方程式为:2NaHSO3═Na2S2O5+H2O
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2 , 其离子方程式为 .
(2)装置Y的作用是
(3)析出固体的反应液经减压抽滤、洗涤、25℃﹣30℃干燥,可获得Na2S2O5固体.
①组成减压抽滤装置的主要仪器是布氏漏斗、和抽气泵.
②依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体.用饱和SO2水溶液洗涤的目的是 .
(4)实验制得的Na2S2O5固体中含有一定量的Na2SO3和Na2SO4 , 其可能的原因是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年诺贝尔化学奖由法国、美国及荷兰的三位化学家分获,以表彰他们在“分子马达”研究方面的成就,一种光驱分子马达结构如图所示.有关该分子的说法正确的是( ) 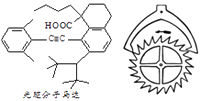
A.该分子中有两个手性碳原子
B.两个苯环可以处于同一平面
C.能与NaHCO3和酸性KMnO4溶液反应
D.1mol该分子最多可与2molH2发生加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴(CoOC2O3)用途广泛,一种利用水钴矿[主要成分为Co2O3,还含少量Fe2O3、Al2O3、MgO、MnO、CaO等]制取CoC2O4·2H2O的工艺流程如下:
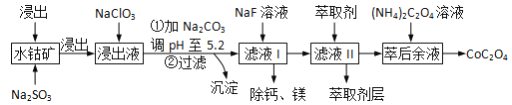
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的作用是将__________还原(填离子符号),该步反应的离子方程式为_________。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+ ,氯元素被还原为最低价。该反应的离子方程式为_______________。
(3)加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是(用离子方程式表示,写出其中一个即可)_____________。
(4)萃取剂对金属离子的萃取率与pH的关系如右图所示。使用萃取剂适宜的pH=________(填序号)左右。
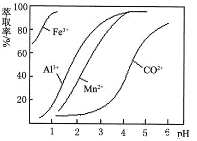
A.2.0 B.3.0 C.4.0
(5)滤液I“除钙,镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,生成N2和H2O(g),已知: N2(g)+2O2(g)═N2O4(g),△H=+8.7kJ/mol;
N2H4(g)+O2(g)═N2(g)+2H2O(g),△H=﹣534.0kJ/mol;
下列表示肼跟N2O4反应的热化学反应方程式,正确的是( )
A.2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g);△H=﹣542.7 kJ/mol
B.2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g);△H=﹣1059.3 kJ/mol
C.N2H4(g)+ ![]() N2O4(g)═
N2O4(g)═ ![]() N2(g)+2H2O(g);△H=﹣1076.7 kJ/mol
N2(g)+2H2O(g);△H=﹣1076.7 kJ/mol
D.2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g);△H=﹣1076.7 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯是无色有毒,带有辛辣气味的易燃液体,结构如右图所示。人体吸入过多的苯乙烯蒸气时会引起中毒,在空气中的允许浓度在1×10-4 kgm-3以下。下列关于苯乙烯的性质推断中正确的是( )

A. 它的分子式是C8H8
B. 它能使溴的四氯化碳溶液褪色,不能使酸性高锰酸钾溶液褪色
C. 它易溶于水,也易溶于有机溶剂
D. 苯乙烯中所有的原子不可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用MnO2催化KClO3分解制取氧气,实验后要分离提纯回收其中的MnO2进行的操作为( )
A. 溶解、过滤、蒸发 B. 溶解、过滤、洗涤、干燥
C. 溶解、过滤、结晶 D. 溶解、结晶、干燥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com